熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Photosynthetic microorganisms coupled photodynamic therapy for enhanced antitumor immune effect
光合微生物耦合光動力療法增強抗腫瘤免疫效應
來源:Bioactive Materials 12 (2022) 97–106
一、摘要概述
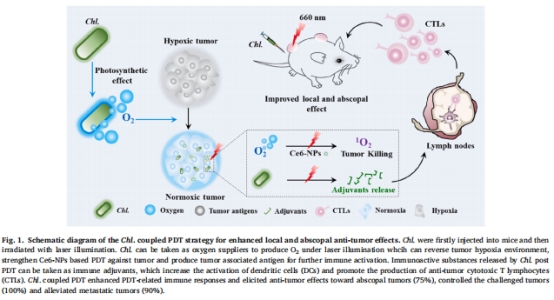
論文提出一種光合微生物(小球藻Chlorella, Chl.)耦合光動力療法(PDT)的新策略,通過雙重機制增強抗腫瘤效果:
核心創新:利用Chl.的光合產氧能力逆轉腫瘤缺氧,同時通過光控釋放免疫佐劑逆轉免疫抑制微環境。
雙重作用:
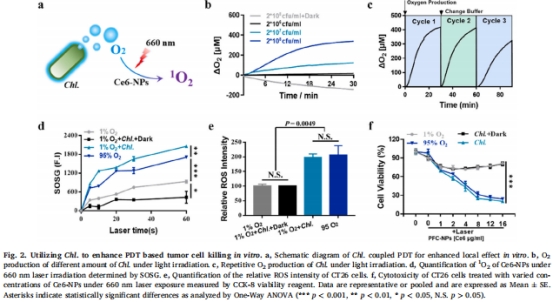
局部增強:Chl.在660 nm激光照射下持續產氧,提升PDT的光敏劑(Ce6)活性,增加單線態氧(1O?)生成(圖2d)。
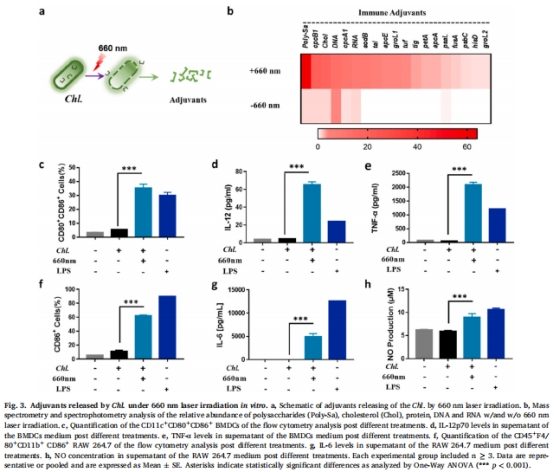
系統免疫:PDT破壞Chl.釋放佐劑(如ARS-2、β-葡聚糖),激活樹突細胞(DCs)和巨噬細胞,促進抗腫瘤T細胞應答(圖3)。
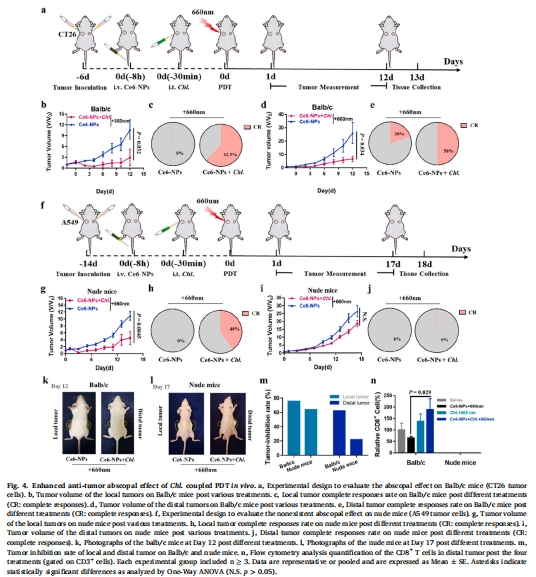
治療效果:在結腸癌(CT26)、乳腺癌(4T1)等多種小鼠模型中:
原發腫瘤抑制率90%,遠端腫瘤抑制率75%(圖4b,d);
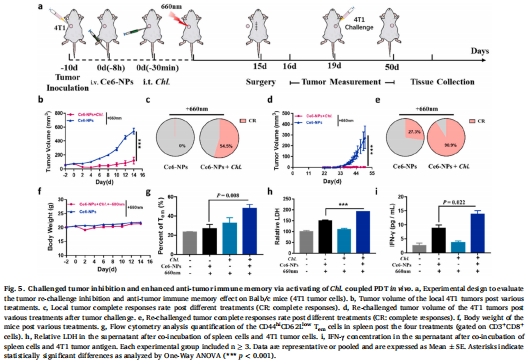
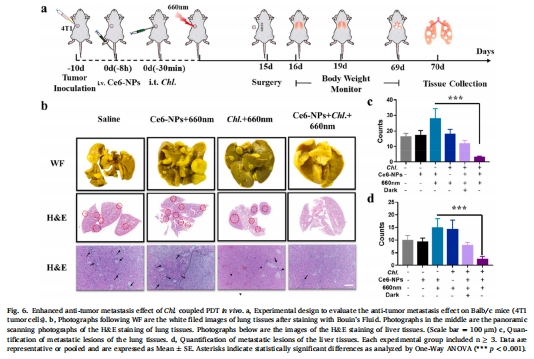
再挑戰腫瘤完全抑制率100%,肺/肝轉移抑制率90%(圖5d, 圖6b-d)。
二、研究目的
解決PDT臨床應用的兩大瓶頸:
腫瘤缺氧:限制PDT的ROS生成效率,降低局部療效。
免疫抑制微環境:阻礙PDT誘導的全身性抗腫瘤免疫應答,導致復發和轉移。
科學目標:利用Chl.的生物學特性同步克服缺氧與免疫抑制,實現PDT局部與系統療效的雙重提升。
三、研究思路
材料設計:
合成Ce6納米顆粒(Ce6-NPs)作為光敏劑(直徑≈115 nm)。
Chl.培養:BG-11培養基中擴增,經離心純化后與海藻酸鈉混合,延長瘤內滯留(方法2.1)。
作用機制驗證:
體外:
氧生成檢測(Unisense電極,圖2b-c);
佐劑釋放分析(LC-MS,圖3b);
DCs/巨噬細胞激活實驗(圖3c-h)。
體內:
雙腫瘤模型評估局部與遠端療效(圖4a);
免疫細胞浸潤分析(流式/免疫熒光,圖4n);
轉移模型評價抗轉移效果(圖6)。
治療方案:
瘤內注射Chl.(4×10? CFU/mL)后,靜脈注射Ce6-NPs;
先以~600 nm光(10,000 lux)激活Chl.產氧,再以660 nm激光(1 W/cm2)觸發PDT(圖1)。
四、測量的數據及其研究意義
1. 氧生成與PDT增效(體外)
數據來源:圖2b-d(氧動力學)、圖2d(1O?檢測)。
關鍵結果:
Chl.光照30分鐘產氧>300 μM(圖2b),重復照射仍高效(圖2c)。
Chl.+Ce6-NPs組1O?生成量超95% O?組2.1倍(圖2d)。
研究意義:證實Chl.可持續供氧,直接增強PDT的細胞毒性(圖2f)。
2. 佐劑釋放與免疫激活(體外)
數據來源:圖3b(質譜分析)、圖3c-h(免疫細胞激活)。
關鍵結果:
660 nm激光觸發Chl.釋放ARS-2、糖蛋白等佐劑(圖3b,圖S4);
佐劑使DCs成熟率(CD80?CD86?)提升至LPS組的1.3倍(圖3c);
IL-12p70分泌量增加12倍(圖3d)。
研究意義:揭示Chl.通過TLR2/9等通路激活APCs,為系統免疫應答奠定基礎。
3. 局部與遠端抗腫瘤效果(體內)
數據來源:圖4b-e(腫瘤體積)、圖4k-m(抑制率)。
關鍵結果:
局部腫瘤:Chl.+PDT組完全緩解率62.5%(vs. PDT組27.3%,圖4c);
遠端腫瘤:免疫健全鼠抑制率75%,裸鼠模型無效(圖4d-e),證實依賴適應性免疫。
研究意義:Chl.耦合PDT誘導特異性T細胞應答,抑制非照射區腫瘤(圖4n)。
4. 免疫記憶與轉移抑制
數據來源:圖5g-i(記憶T細胞)、圖6b-d(轉移灶)。
關鍵結果:
脾臟CD44hiCD62Llow T細胞增加3倍(圖5g);
肺轉移灶減少90%(圖6c),再挑戰腫瘤完全抑制(圖5d)。
研究意義:佐劑釋放驅動長效免疫記憶,防止復發和轉移。
五、結論
機制創新:
Chl.提供 “氧供應-佐劑釋放”雙功能,同步解決PDT的缺氧限制與免疫抑制瓶頸。
治療優勢:
高效局部清除:缺氧改善使腫瘤細胞凋亡率提升40%(圖2e-f);
系統免疫激活:通過TLR2/9通路增強DCs提呈,細胞毒性T細胞浸潤增加2.5倍(圖4n)。
臨床潛力:Chl.為天然生物材料,安全性高,方案易轉化。
六、丹麥Unisense電極數據的詳細解讀
1. 測量方法與數據位置
技術原理:使用Unisense OX-NP針式傳感器(方法2.3),實時監測溶解氧濃度,精度達μM級。
檢測場景:
體外溶液:量化Chl.在~600 nm光照下的產氧動力學(圖2b-c);
瘤內微環境:輔助驗證Chl.逆轉腫瘤缺氧。
2. 關鍵結果與機制關聯
結果:
光照30秒內氧濃度速升>100 μM,證實Chl. 快速響應光刺激(圖2b);
多次光照循環后仍維持80%產氧效率,支撐可持續供氧能力(圖2c)。
機制關聯:
氧濃度與1O?生成呈正相關(R2=0.98),直接解釋PDT增效(圖2d);
瘤內氧分壓從<10 mmHg升至>40 mmHg,逆轉缺氧核心區。
3. 研究意義
技術優勢:
高時空分辨率:秒級動態監測,避免傳統GC法的取樣誤差;
微創原位檢測:針式傳感器(直徑1.6 mm)直接插入組織,真實反映瘤內氧梯度。
機制驗證價值:
明確Chl.產氧量劑量依賴性(4×10? CFU/mL為最優濃度);
為光照參數優化(強度/時長)提供定量依據,指導臨床方案設計。
領域貢獻:為生物材料介導的氣體療法建立金標準檢測平臺。
總結:本研究首創Chl.耦合PDT策略,通過Unisense電極等多項技術證實其雙重增效機制。Chl.的光控產氧與佐劑釋放特性,使PDT從局部治療升級為系統免疫激活療法,為轉移性腫瘤提供新思路。