熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Thyroid hormone increases oxygen metabolism causing intrarenal tissue hypoxia; a pathway to kidney disease
甲狀腺激素增加氧代謝,導(dǎo)致腎內(nèi)組織缺氧;導(dǎo)致腎臟疾病的途徑
來(lái)源: PLoS ONE 17(3): e0264524
一、摘要概述
本研究通過(guò)三碘甲狀腺原氨酸(T3)誘導(dǎo)腎臟氧耗增加,探究腎組織缺氧本身是否直接導(dǎo)致腎病:
核心發(fā)現(xiàn):
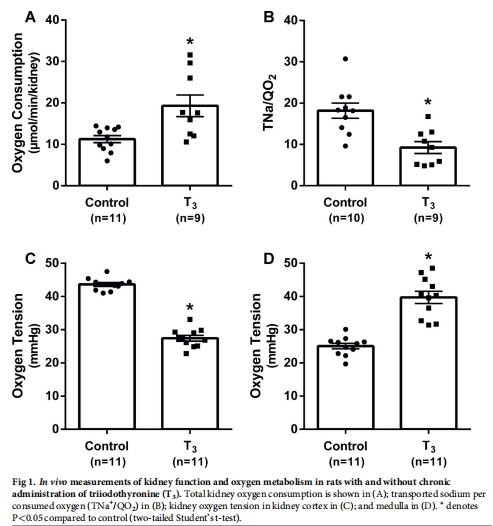
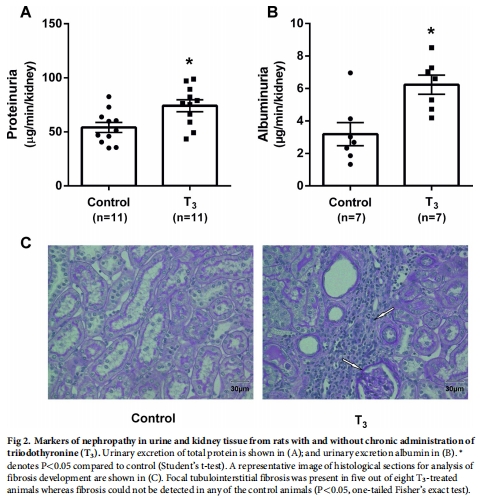
T3處理7周顯著增加大鼠腎臟總氧耗(QO?),導(dǎo)致腎皮質(zhì)缺氧(圖1C),并誘發(fā)腎病(蛋白尿、腎小管間質(zhì)纖維化)(圖2)。
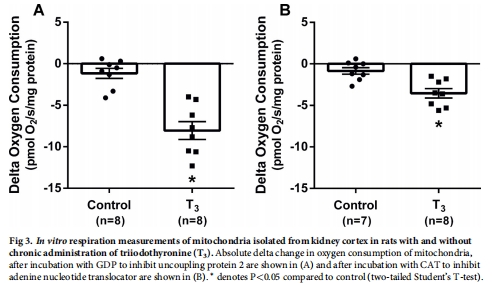
機(jī)制上,T3通過(guò)線粒體解偶聯(lián)(UCP-2和ANT介導(dǎo))增加氧耗(圖3),且該過(guò)程獨(dú)立于高血壓、高血糖和氧化應(yīng)激(表2)。
創(chuàng)新點(diǎn):首次通過(guò)甲狀腺激素模型排除混雜因素(如糖尿病、高血壓),直接證明腎組織缺氧是腎病的獨(dú)立致病通路。
二、研究目的
解決兩大科學(xué)問(wèn)題:
驗(yàn)證缺氧假說(shuō):在排除高血糖、高血壓等混雜因素后,明確腎組織缺氧是否直接導(dǎo)致腎病。
揭示機(jī)制:探究T3增加腎氧耗的具體分子機(jī)制(尤其線粒體功能)。
三、研究思路
采用體內(nèi)-體外結(jié)合的實(shí)驗(yàn)設(shè)計(jì):
動(dòng)物模型:
健康SD大鼠分為兩組:
對(duì)照組:僅用血管緊張素受體拮抗劑坎地沙坦(阻斷T3誘導(dǎo)的腎素釋放)。
T3組:T3(10μg/kg/天)+坎地沙坦,干預(yù)7周。
目的:排除RAAS激活對(duì)血壓/氧化應(yīng)激的干擾。
體內(nèi)檢測(cè):
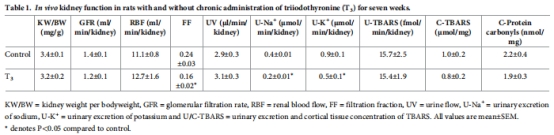
腎功能:腎小球?yàn)V過(guò)率(GFR)、腎血流量(RBF)(表1)。
氧代謝:Clark氧電極(Unisense)測(cè)量皮質(zhì)/髓質(zhì)氧分壓(圖1C-D)。
腎病標(biāo)志物:蛋白尿、白蛋白尿(圖2A-B)、組織纖維化(圖2C)。
線粒體功能:
離體腎皮質(zhì)線粒體呼吸檢測(cè)(Oroboros O2k系統(tǒng))(圖3)。
排除混雜因素:
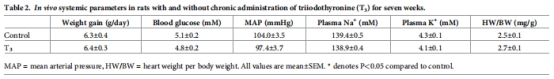
監(jiān)測(cè)血糖、血壓、氧化應(yīng)激(TBARS、蛋白羰基化)(表1-2)。
四、測(cè)量的數(shù)據(jù)及其研究意義
1. 腎氧代謝與缺氧(體內(nèi))
數(shù)據(jù)來(lái)源:圖1(氧耗與氧分壓)、表1(腎功能)。
關(guān)鍵結(jié)果:
T3組總腎氧耗(QO?)↑35%(圖1A),皮質(zhì)氧分壓↓40%(圖1C),髓質(zhì)氧分壓↑(圖1D)。
GFR、RBF無(wú)變化(表1),證實(shí)缺氧源于代謝增加而非灌注不足。
研究意義:首次在無(wú)代謝疾病模型中證明氧耗增加直接導(dǎo)致皮質(zhì)缺氧。
2. 腎病表型
數(shù)據(jù)來(lái)源:圖2(蛋白尿/纖維化)。
關(guān)鍵結(jié)果:
T3組白蛋白尿↑3倍(圖2B),5/8動(dòng)物出現(xiàn)腎小管間質(zhì)纖維化(圖2C)。
研究意義:缺氧直接誘發(fā)腎損傷,支持“缺氧是腎病統(tǒng)一通路”假說(shuō)。
3. 線粒體機(jī)制(體外)
數(shù)據(jù)來(lái)源:圖3(線粒體呼吸)、表2(全身參數(shù))。
關(guān)鍵結(jié)果:
T3組線粒體解偶聯(lián)↑:UCP-2和ANT介導(dǎo)的質(zhì)子漏增加(圖3A-B),基礎(chǔ)質(zhì)子漏↑80%。
呼吸控制比(RCR)↑,表明ATP合成效率↑(正文)。
研究意義:T3通過(guò)增加線粒體質(zhì)子漏提升氧耗,與ATP生成無(wú)關(guān)。
4. 混雜因素排除
數(shù)據(jù)來(lái)源:表2(全身參數(shù))、表1(氧化應(yīng)激)。
關(guān)鍵結(jié)果:
血糖、血壓、心臟重量無(wú)變化(表2)。
腎組織TBARS(氧化應(yīng)激標(biāo)志物)無(wú)差異(表1)。
研究意義:證實(shí)腎病由缺氧本身驅(qū)動(dòng),獨(dú)立于經(jīng)典風(fēng)險(xiǎn)因素。
五、結(jié)論
核心結(jié)論:
T3通過(guò)線粒體解偶聯(lián)(UCP-2/ANT)增加腎氧耗,導(dǎo)致皮質(zhì)缺氧,直接誘發(fā)腎病。
該過(guò)程獨(dú)立于高血壓、高血糖及氧化應(yīng)激,為“缺氧致腎病”假說(shuō)提供最直接證據(jù)。
臨床意義:
解釋甲狀腺功能亢進(jìn)患者腎損傷機(jī)制(約30%出現(xiàn)蛋白尿)。
提示靶向線粒體解偶聯(lián)或改善腎氧供為腎病防治新策略。
六、丹麥Unisense電極數(shù)據(jù)的詳細(xì)解讀
1. 測(cè)量方法與數(shù)據(jù)位置
技術(shù)原理:使用Unisense Clark型氧電極(方法部分),實(shí)時(shí)監(jiān)測(cè)腎組織氧分壓(PO?),空間分辨率達(dá)細(xì)胞水平。
檢測(cè)場(chǎng)景:
皮質(zhì)/髓質(zhì)PO?:電極直接插入腎皮質(zhì)(圖1C)和髓質(zhì)(圖1D),連續(xù)記錄穩(wěn)態(tài)氧分壓。
校準(zhǔn)標(biāo)準(zhǔn):電極預(yù)校準(zhǔn)于0%(無(wú)氧)和100%(空氣飽和)氧分壓環(huán)境。
2. 關(guān)鍵結(jié)果與機(jī)制關(guān)聯(lián)
結(jié)果:
皮質(zhì)PO?:對(duì)照組≈40 mmHg → T3組≈25 mmHg(圖1C)。
髓質(zhì)PO?:對(duì)照組≈15 mmHg → T3組≈20 mmHg(圖1D)。
機(jī)制關(guān)聯(lián):
皮質(zhì)缺氧:直接由氧耗增加(QO?↑)引起,與血流無(wú)關(guān)(RBF不變)。
髓質(zhì)氧合改善:可能因近端小管鈉重吸收↑,減少髓袢升支粗段耗氧(討論)。
3. 研究意義
技術(shù)優(yōu)勢(shì):
高時(shí)空分辨率:實(shí)時(shí)原位監(jiān)測(cè)不同腎區(qū)氧動(dòng)態(tài),避免離體檢測(cè)失真。
微創(chuàng)定量:優(yōu)于組織染色等半定量方法,提供PO?絕對(duì)值。
科學(xué)價(jià)值:
首次在非糖尿病/高血壓模型中量化皮質(zhì)缺氧程度(PO?↓15 mmHg),確立缺氧與腎病的因果關(guān)系。
揭示腎區(qū)特異性缺氧模式:皮質(zhì)敏感而髓質(zhì)耐受,指導(dǎo)靶向干預(yù)。
領(lǐng)域貢獻(xiàn):為“腎臟缺氧理論”提供關(guān)鍵實(shí)驗(yàn)工具,推動(dòng)缺氧靶向治療研究。
總結(jié):本研究通過(guò)Unisense電極等多項(xiàng)技術(shù),證明甲狀腺激素通過(guò)線粒體解偶聯(lián)增加腎氧耗,導(dǎo)致皮質(zhì)缺氧并誘發(fā)腎病,為腎病防治提供了新靶點(diǎn)。