熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
NIR-photocatalytic regulation of arthritic synovial microenvironment
近紅外光催化調節關節炎滑膜微環境
來源:Zhao et al., Sci. Adv. 8, eabq0959 (2022) 5 October 2022
一、摘要概述
本研究提出滑膜微環境(SME)光催化調控新策略,開發了全溶液法制備的氫摻雜二氧化鈦納米棒(HTON),通過近紅外(NIR)光催化實現關節炎治療:
核心發現:
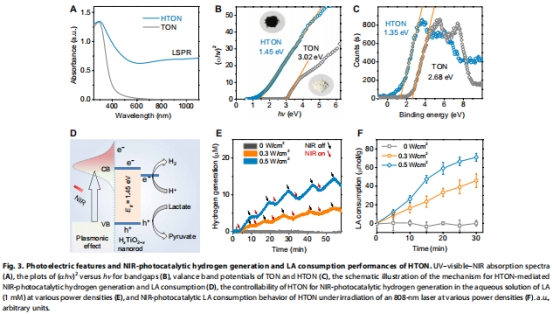
HTON在808 nm激光照射下同步產生氫分子(H?)并消耗過量乳酸(LA)(圖3E-F)。
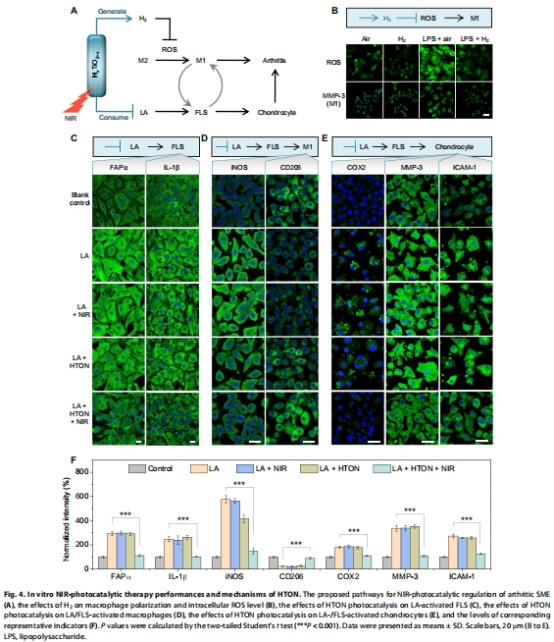
H?清除活性氧(ROS)促進巨噬細胞向抗炎M2表型極化(圖4B),LA消耗抑制滑膜細胞/巨噬細胞炎癥表型(圖4C-E)。
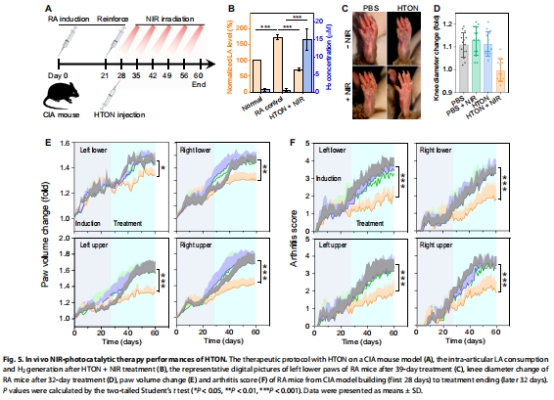
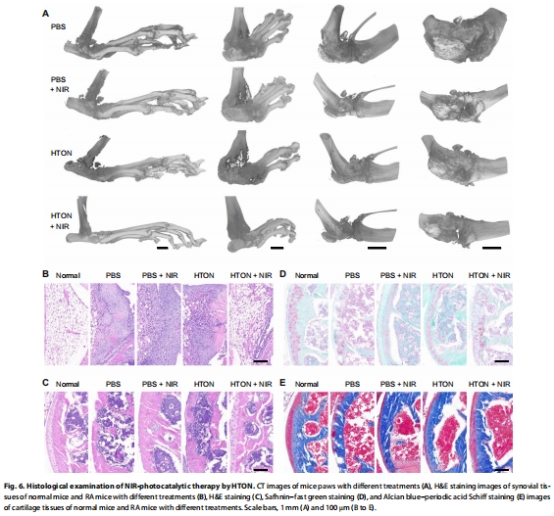
在小鼠膠原誘導關節炎(CIA)模型中,HTON顯著抑制滑膜血管翳形成和軟骨破壞(圖5-6)。
創新點:首例NIR光催化調控SME的關節炎治療策略,實現“一石二鳥”的代謝校正與抗炎協同效應。
二、研究目的
解決兩大關鍵問題:
靶向SME代謝失衡:逆轉關節炎滑膜中乳酸堆積(~7.2 mM)和ROS過表達驅動的炎癥級聯反應。
開發精準治療工具:構建生物相容性光催化劑,實現NIR觸發、可持續的H?生成與LA消耗。
三、研究思路
采用材料開發-機制驗證-動物治療三級遞進策略:
材料合成:
水熱法制備金紅石單晶TiO?納米棒(TON),全溶液氫摻雜得HTON(圖2A-G)。
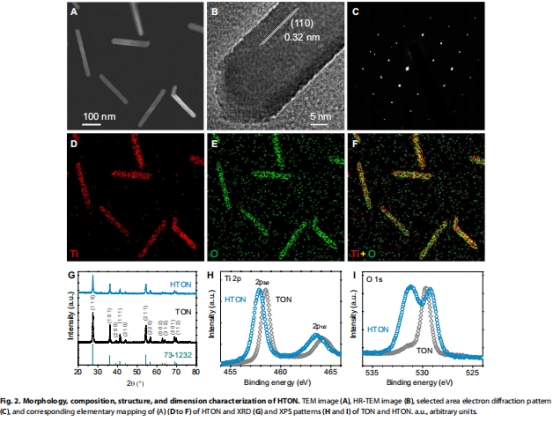
表征確認氫摻雜導致晶格缺陷(XPS圖2H-I)、能帶窄化(1.45 eV),實現NIR吸收(圖3A-D)。
體外機制:
LA(1 mM)激活滑膜細胞(FLS)炎癥表型(FAPα↑, MMP-3↑),HTON光催化抑制其增殖(圖4C)。
H?降低巨噬細胞ROS,促進M2極化(CD206↑)(圖4B,D)。
體內治療:
CIA小鼠關節腔注射HTON,808 nm激光照射(0.3 W/cm2,每周1次),顯著降低關節腫脹(圖5C-E)和軟骨破壞(圖6)。
四、測量的數據及其研究意義
1. 材料表征數據
來源:圖2(TEM/XRD/XPS)、圖3(紫外-可見光譜)。
關鍵結果:
HTON保持棒狀形貌(長150±20 nm),氫摻雜使晶面間距增大(HR-TEM),XPS顯示Ti-OH缺陷峰(圖2H)。
能帶結構:價帶+1.15 eV,導帶-0.3 eV,滿足LA氧化/H?還原電位(圖3D)。
研究意義:證實HTON具備NIR光催化活性基礎,為生物應用提供材料學依據。
2. 光催化性能數據
來源:圖3E-F(H?/LA動力學)、圖5B(體內LA/H?)。
關鍵結果:
體外:0.5 W/cm2激光照射30 min,LA消耗率>40%,H?生成速率15 μM/h(圖3E-F)。
體內:關節腔HTON注射后,LA降低50%,H?濃度達15 μM(圖5B)。
研究意義:首次實現關節腔內原位光催化代謝調控,驗證“同步產H?-耗LA”策略可行性。
3. 治療效果數據
來源:圖5(關節腫脹)、圖6(組織學)、圖7(SME調控)。
關鍵結果:
治療32天:膝關節直徑下降30%(圖5D),關節炎評分從3.8降至1.2(圖5F)。
微CT顯示軟骨侵蝕減少,H&E染色證實滑膜增生抑制(圖6B)。
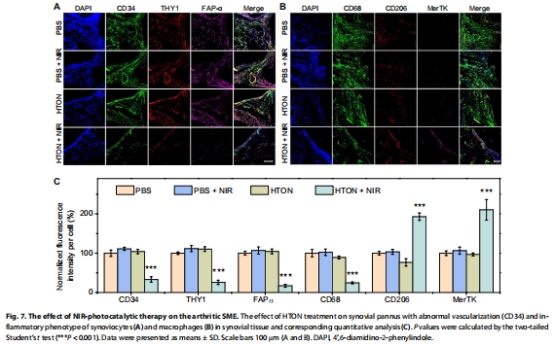
免疫熒光:FLS中FAPα↓,巨噬細胞CD206↑(圖7A-C)。
研究意義:證實光催化調控SME可阻斷“乳酸-炎癥”正反饋循環,為關節炎治療提供新范式。
五、結論
機制層面:
HTON介導的NIR光催化通過雙路徑調控SME:H?清除ROS抑制炎癥,LA消耗阻斷滑膜細胞/巨噬細胞異常活化。
治療層面:
顯著改善CIA小鼠關節腫脹(p<0.001),抑制軟骨破壞,效果優于單一H?或LA干預。
臨床意義:
開辟“催化醫學”新領域,為代謝性炎癥疾病提供可觸發、可持續的治療策略。
六、丹麥Unisense電極數據的詳細解讀
1. 測量原理與實驗設計
技術原理:
Unisense氫微電極基于電化學還原反應(H? + 2e? → 2H?),電流信號∝ H?濃度。
空間分辨率:微米級;時間分辨率:實時監測(方法章節)。
實驗設計:
使用特殊擴散池(MWCO=3000 Da濾膜分隔),HTON在模擬滑液(含1 mM LA)中光照,電極實時監測H?生成(圖3E)。
2. 關鍵數據與生物學意義
數據產出:
圖3E:0.5 W/cm2照射下,H?濃度在10 min內達15 μM,關閉激光后速降,證實光控H?釋放。
圖5B:體內關節腔檢測到相同H?濃度,驗證跨物種催化一致性。
研究意義:
首證關節腔內光催化產氫:解決傳統H?遞送系統(如Mg顆粒)的爆發釋放難題,實現按需供給。
定量治療劑量窗口:15 μM H?為最佳抗炎濃度(對比文獻值),為臨床轉化提供參數依據。
3. 技術優勢與領域貢獻
創新性:
克服傳統檢測局限(如氣相色譜離線采樣),實現原位、實時、動態監測生物腔內氣體代謝。
普適價值:
為炎癥微環境(如腫瘤、傷口)的氣體分子(NO/H?S/H?)研究提供標準化監測方案。
總結:本研究通過Unisense微電極等多項技術,首次量化關節炎關節腔光催化產氫過程,證實HTON介導的SME調控可高效阻斷炎癥級聯反應,為代謝性炎癥疾病治療開辟新途徑。