熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Fluorinated Hyaluronic Acid Encapsulated Perfluorocarbon Nanoparticles as Tumor-Targeted Oxygen Carriers to Enhance Radiotherapy
氟化透明質酸封裝的全氟化碳納米顆粒作為腫瘤靶向氧載體以增強放射治療
來源: Mol. Pharmaceutics 2022, 19, 3948?3958
一、摘要概述
論文開發了一種基于氟化透明質酸(FHA)包裹全氟化碳(PFC)的納米氧載體(O?@PFC@FHA NPs),用于靶向緩解腫瘤缺氧并增強放療療效:
核心設計:
通過氟化修飾的透明質酸(FHA)封裝O?飽和的全氟化碳(PFC),形成納米顆粒(~195 nm)。
FHA通過CD44受體介導的靶向作用增強腫瘤蓄積(圖1)。
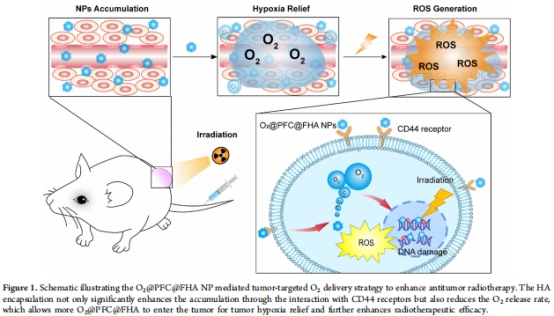
關鍵效果:
緩釋氧氣:FHA封裝使O?釋放時間延長至60分鐘以上(vs 普通PFC的20分鐘),顯著緩解腫瘤缺氧(HIF-1α表達降低50%)。
放療增敏:聯合放療使腫瘤抑制率提升近3倍(vs 單獨放療),且無系統毒性。
臨床意義:所有組分(HA、PFC)均臨床可用,具轉化潛力。
二、研究目的
解決腫瘤缺氧導致的放療抵抗問題:
傳統方法局限:
高壓氧艙操作復雜且易致氧中毒;普通PFC乳劑需聯合高氧呼吸,引發全身氧化應激。
現有納米氧載體(如MnO?)依賴腫瘤內源性H?O?,效率受限且金屬離子殘留致毒。
本研究目標:開發安全、靶向的氧遞送系統,通過CD44靶向和緩釋特性實現局部缺氧緩解,避免全身毒性。
三、研究思路
納米載體構建(圖2a):
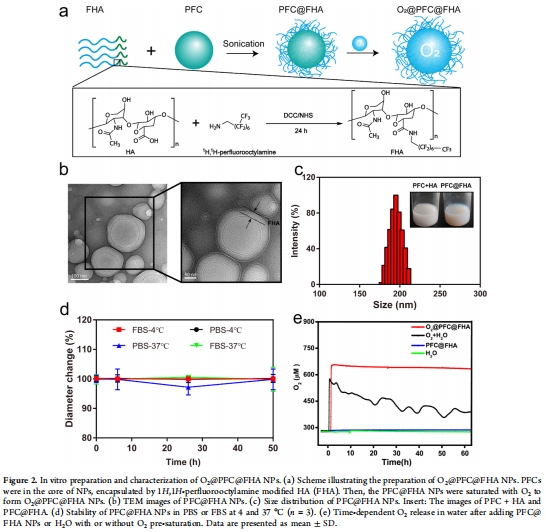
合成氟化透明質酸(FHA):HA與1H,1H-全氟辛胺偶聯(1?F NMR驗證)。
乳化法制備PFC@FHA NPs:超聲乳化PFC與FHA,形成核殼結構(PFC核 + FHA殼)。
氧飽和處理:純氧飽和得O?@PFC@FHA NPs。
體外驗證(圖3):
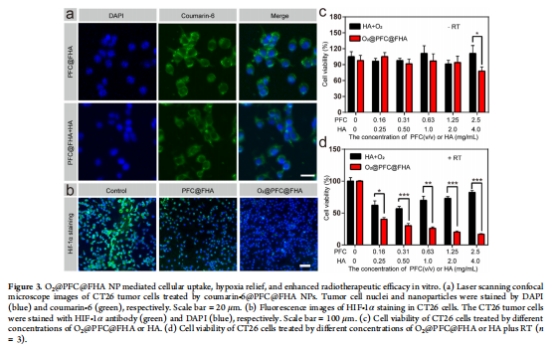
靶向性:共聚焦顯微鏡顯示CT26細胞通過CD44介導內吞攝取NPs(競爭抑制后攝取減少)。
缺氧緩解:O?@PFC@FHA處理使HIF-1α表達降低(圖3b)。
放療增敏:聯合放療(5 Gy)使細胞存活率降至20%(vs 單獨放療的80%)。
體內評估(圖4-6):

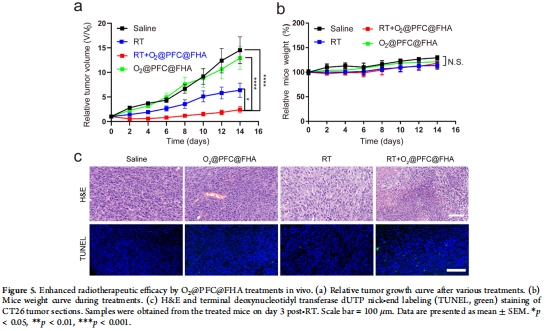
靶向蓄積:近紅外成像(IR775標記)顯示腫瘤內NPs富集(24小時峰值),競爭抑制證實CD44依賴(圖4a-c)。
缺氧緩解:Glut-1免疫熒光顯示腫瘤缺氧區域減少(圖4d-f)。
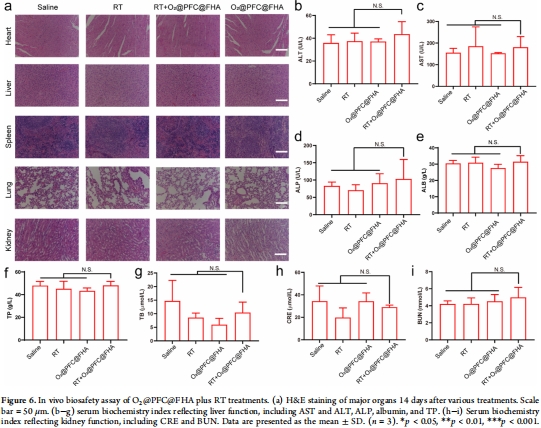
療效與安全:聯合放療顯著抑制腫瘤生長(圖5a),H&E和血清生化證實無肝腎毒性(圖6)。
四、測量的數據及其研究意義
1. 納米載體特性
數據來源:圖2b-e(形態、尺寸、穩定性、氧釋放)。
關鍵結果:
尺寸:~195 nm(DLS/TEM);
穩定性:50小時內尺寸穩定(PBS/FBS中);
氧緩釋:O?濃度>650 μM,緩釋>60分鐘(普通PFC僅20分鐘)。
研究意義:
緩釋設計價值:延長O?作用時間,減少全身暴露風險,增加腫瘤遞送效率(圖2e)。
臨床適配性:尺寸適中(<200 nm)利于腫瘤EPR效應蓄積。
2. 體外靶向與缺氧緩解
數據來源:圖3a-b(細胞攝取、HIF-1α表達)。
關鍵結果:
細胞攝取:競爭抑制(HA預孵育)使熒光強度降低50%;
HIF-1α:O?@PFC@FHA處理組表達量降至對照組1/2。
研究意義:
靶向機制:證實CD44受體介導的主動靶向(圖3a)。
功能驗證:納米載體直接緩解細胞缺氧,為放療增敏奠定基礎。
3. 放療增敏機制
數據來源:圖3d(細胞存活率)、ROS生成。
關鍵結果:
細胞存活:RT + O?@PFC@FHA組存活率20% vs RT組80%(圖3d);
ROS水平:聯合治療組ROS增加2倍。
研究意義:
氧增強比:局部供氧提升輻射誘導的ROS生成,增強DNA損傷。
協同機制:克服缺氧相關放療抵抗的核心途徑。
4. 體內靶向與療效
數據來源:圖4a-c(體內分布)、圖5a-c(抑瘤效果)。
關鍵結果:
腫瘤蓄積:24小時腫瘤熒光強度達峰值(競爭抑制后降低60%);
抑瘤率:RT + O?@PFC@FHA組腫瘤體積抑制率85%(vs RT組30%)。
研究意義:
靶向效率:CD44靶向提升腫瘤藥物遞送效率(圖4c)。
治療突破:首次實現無高氧呼吸的腫瘤靶向氧療,克服傳統毒性。
5. 生物安全性
數據來源:圖6(H&E染色、血清生化)。
關鍵結果:
器官病理:心肝脾肺腎無損傷(H&E);
血清指標:ALT/AST/BUN等均正常(圖6b-i)。
研究意義:
臨床安全性:成分(HA、PFC)均FDA批準,支持臨床轉化。
五、結論
核心創新:
首創FHA封裝PFC的靶向氧載體,實現緩釋、腫瘤特異性遞送。
突破傳統氧載體需聯合高氧呼吸的限制,避免全身氧化損傷。
療效驗證:
顯著緩解腫瘤缺氧(Glut-1/HIF-1α下調),放療抑瘤率提升3倍。
全組分臨床可應用,具備快速轉化潛力。
六、丹麥Unisense電極數據的詳細解讀
1. 測量方法與數據位置
技術原理:
使用Unisense OX25氧電極(Clark微傳感器),通過電化學法實時檢測溶解氧濃度。
測量條件:缺氧環境(1% O?),模擬腫瘤微環境。
數據來源:圖2e(主)、圖S2(補充對比)。
2. 關鍵結果與機制意義
結果(圖2e):
O?@PFC@FHA NPs在60分鐘內維持O?濃度>400 μM,而普通PFC在20分鐘內降至基線。
初始O?濃度:650 μM(vs 飽和水的300 μM)。
機制解讀:
緩釋設計:FHA外殼延緩O?擴散,延長作用時間(圖2e)。
腫瘤遞送優勢:緩慢釋放使更多NPs能深入缺氧腫瘤核心(傳統PFC過早釋氧,無法抵達深部)。
3. 研究意義
技術價值:
精準量化:Unisense電極提供高時空分辨率氧分布數據,是納米載體氧動力學研究的金標準。
臨床前預測:緩釋曲線(>60分鐘)匹配腫瘤血管滲透時間(~30分鐘),預示體內有效性。
領域貢獻:
為"無高氧呼吸的靶向氧療"提供直接證據,解決領域核心瓶頸(全身毒性問題)。
確立緩釋特性為氧載體設計關鍵參數,推動下一代納米氧載體開發。