熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
N2O production and emission pathways in anammox biofilter for treating wastewater with low nitrogen concentrations
厭氧氨氧化生物濾池處理低氮廢水的N 2 O產生和排放途徑
來源:Science of the Total Environment 852 (2022) 158282
摘要核心內容
本研究針對厭氧氨氧化(Anammox)生物濾池處理低氮廢水時的N?O排放問題,通過調控濾速(1.0–3.0 m/h),結合微電極實時監測、穩定同位素示蹤及微生物群落分析,揭示了N?O產生路徑及控制策略。核心發現包括:
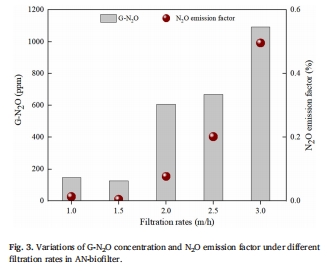
濾速對N?O的影響:N?O產量隨濾速增加顯著上升,排放因子從1.5 m/h時的0.004%升至3.0 m/h時的0.496%(圖3)。
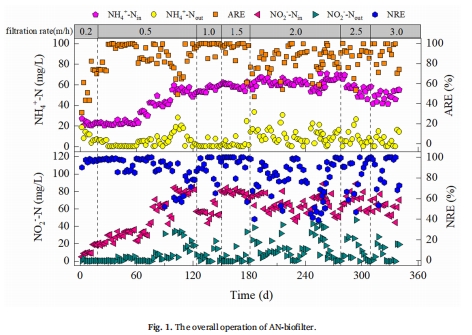
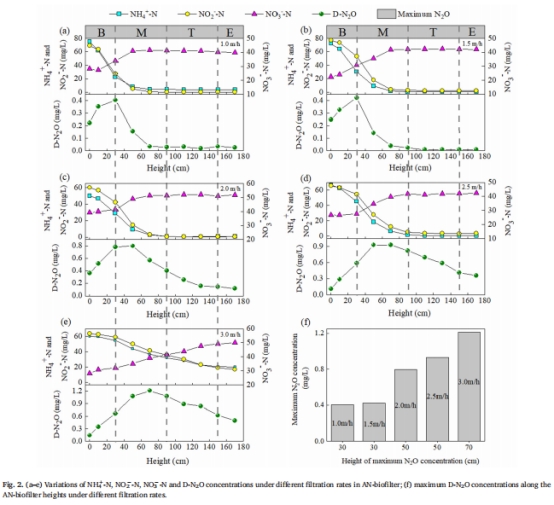
最優操作條件:濾速1.5 m/h時脫氮效率最高(NH??-N和NO??-N去除率>99%),且N?O產量最低(圖1, 圖2f)。
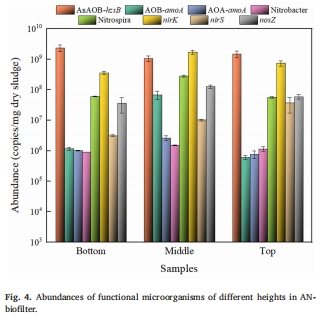
微生物群落特征:Anammox菌(hzsB基因)占主導,但硝化菌(AOB-amoA)和反硝化菌(nirK/nirS)共存,為N?O產生提供條件(圖4)。
N?O產生路徑:
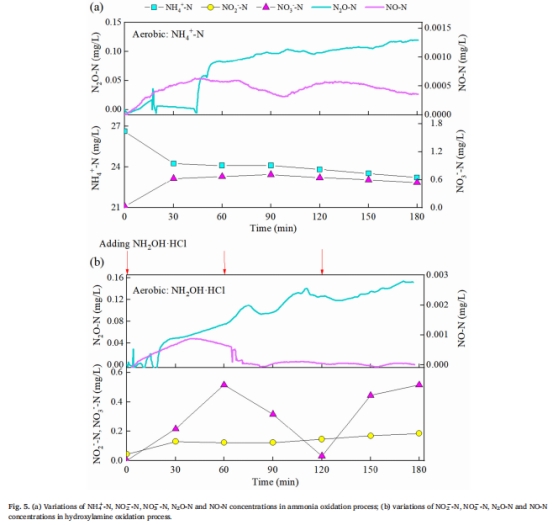
好氧區:AOB反硝化(52.5%)和NH?OH氧化(47.5%)為主要路徑(圖5a)。
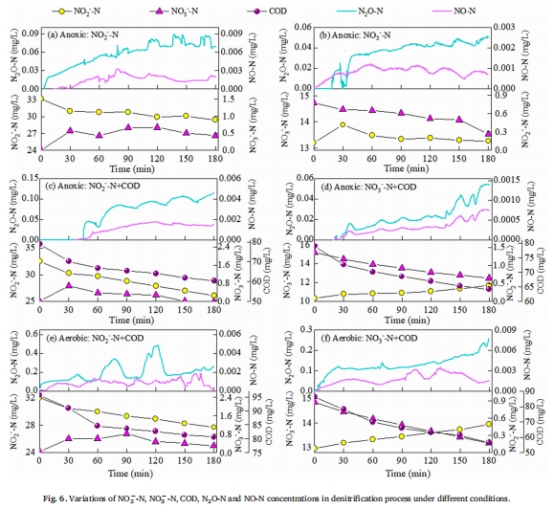
缺氧區:內源異養反硝化主導(圖6, 圖7)。
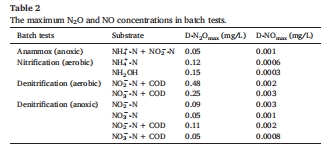
減排策略:厭氧環境可顯著降低N?O產量(表2)。
研究目的
量化N?O排放:探究不同濾速下溶解態(D-N?O)和氣態(G-N?O)N?O的生成規律。
解析微生物作用:識別Anammox生物濾池中參與脫氮及N?O產生的功能微生物。
明確產生路徑:通過批次實驗和同位素示蹤,確定N?O的關鍵生成途徑。
研究思路與技術路線
采用 梯度濾速運行→微生物群落分析→路徑驗證 的三步策略:
長期濾柱運行:
在厭氧氨氧化生物濾池(AN-biofilter)中設置濾速梯度(1.0–3.0 m/h),監測沿濾柱高度的氮形態變化及N?O濃度(圖2a-e)。
使用氣相色譜分析氣態N?O,計算排放因子(圖3)。
微生物群落解析:
qPCR定量功能基因(hzsB, amoA, nirK, nirS等),明確Anammox菌、硝化菌及反硝化菌的豐度分布(圖4)。
批次實驗驗證:
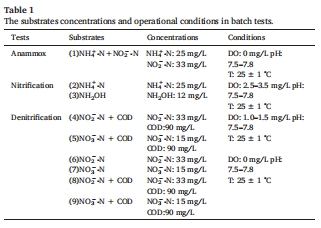
設計9組批次實驗(表1),結合丹麥Unisense N?O/NO微電極實時監測溶解氣體,并通過穩定同位素質譜(1?N)量化不同路徑貢獻(圖5-7)。
關鍵數據及研究意義
1. 濾速對N?O的影響(圖2, 圖3)
數據:濾速從1.5 m/h升至3.0 m/h時,D-N?O峰值濃度從0.42 mg/L增至1.21 mg/L(圖2f),G-N?O濃度從124 ppm升至1093 ppm(圖3)。
意義:首次建立濾速與N?O排放的定量關系,為優化生物濾池運行參數(推薦1.5 m/h)提供依據,避免盲目提高負荷導致的溫室氣體排放激增。
2. 微生物群落特征(圖4)
數據:Anammox菌(hzsB)豐度最高(2.38×10? copies/g),但反硝化菌(nirK+nirS)總量超過硝化菌(amoA),且中層(M區)nirK基因豐度最高(1.71×10? copies/g),與N?O峰值區對應。
意義:揭示“Anammox菌主導脫氮,但反硝化菌驅動N?O產生”的互作機制,修正了“Anammox過程不產N?O”的傳統認知。
3. N?O產生路徑(圖5-7, 表2)
數據:
好氧區:NH?OH氧化路徑貢獻47.5%,且添加NH?OH時N?O濃度升至0.15 mg/L(圖5b)。
缺氧區:內源反硝化(無外碳源)產生N?O 0.09 mg/L,遠低于好氧條件下的0.48 mg/L(表2)。
意義:明確生物濾池中N?O的空間分異路徑,強調好氧區是減排重點。
4. 厭氧環境減排效應(表2)
數據:缺氧條件下N?O濃度僅為好氧條件的1/5(如NO??+COD時0.11 mg/L vs. 0.48 mg/L)。
意義:證實嚴格厭氧操作可有效抑制N?O生成,為工藝優化提供理論支撐。
核心結論
濾速調控是關鍵:1.5 m/h為最優濾速,平衡高脫氮效率(>99%)與低N?O排放(0.004%)。
微生物互作驅動N?O產生:Anammox菌主導脫氮,但共存的反硝化菌(尤其nirK型)是N?O主要生產者。
路徑分異明顯:
好氧區以AOB反硝化和NH?OH氧化為主(共占100%)。
缺氧區依賴內源反硝化。
厭氧環境減排有效:嚴格缺氧使N?O產量降低80%,支持Anammox系統向厭氧條件傾斜。
Unisense電極數據的專項解讀
技術原理與部署
型號與功能:丹麥Unisense N?O和NO微電極,檢測限0.001 mg/L,實時監測溶解態氣體動態(2.3節)。
應用場景:
批次實驗中在線跟蹤N?O/NO生成曲線(圖5a-b, 圖6, 圖7)。
結合密閉反應器,同步獲取溶解氣體與液相氮素數據(表1)。
關鍵發現與機制解析
NH?OH氧化的瞬時監測(圖5b):
電極捕捉到NH?OH添加后N?O濃度驟升(0→0.15 mg/L),且伴隨NO脈沖式釋放(峰值0.0003 mg/L),直接驗證NH?OH→N?O路徑的化學機制。
好氧vs.缺氧的N?O動力學差異(圖6, 表2):
好氧條件下N?O快速積累(0.48 mg/L),而缺氧條件下緩慢上升且峰值更低(0.11 mg/L),揭示氧氣對N?O還原酶的抑制效應。
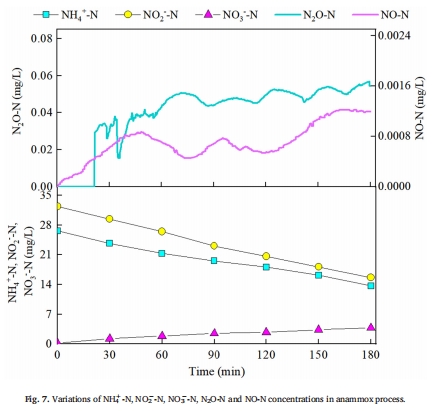
Anammox過程的低N?O特征(圖7):
電極顯示Anammox反應中N?O濃度始終<0.05 mg/L,且無NO累積,排除Anammox菌直接產N?O的可能性。
研究意義
方法學創新:
首次將Unisense電極應用于Anammox生物濾池,實現溶解態N?O/NO的高分辨率原位監測。
克服傳統離線分析的滯后性,精準捕捉瞬態反應(如NH?OH氧化的分鐘級響應)。
機制深度解析:
量化不同路徑貢獻(如NH?OH氧化占47.5%),糾正“AOB反硝化主導”的單一認知。
通過NO信號(圖5a)驗證硝化菌反硝化路徑的NO中間產物,完善N?O產生鏈條。
應用指導價值:
實時數據證明嚴格厭氧可削減80% N?O(表2),為工藝調控提供直接依據。
電極監測與qPCR聯動,建立“微生物功能基因→代謝活動→氣體釋放”的完整證據鏈。
理論與應用價值
優化工藝運行:推薦生物濾池濾速≤1.5 m/h,并強化厭氧段控制以降低N?O排放。
修正Anammox認知:單一Anammox系統仍存在N?O排放風險,需協同調控共存菌群。
電極技術推廣:Unisense微電極適用于生物膜/顆粒污泥等復雜體系,為污水廠溫室氣體監測提供可靠工具。
總結:本研究通過Unisense電極揭示濾速與N?O產生的定量關系,明確Anammox生物濾池中N?O的三重產生路徑,并證實厭氧環境是減排關鍵。成果為厭氧氨氧化工藝的可持續應用提供理論支持與方法學示范。