熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Biofilm stratification in counter-diffused membrane biofilm bioreactors (MBfRs) for aerobic methane oxidation coupled to aerobic/anoxic denitrification
逆擴散膜生物膜生物反應器(MBfRs)中的生物膜分層 與好氧甲烷氧化耦合的好氧缺氧反硝化的影響氧氣壓力的影響
來源:Water Research 226 (2022) 119243
摘要核心內容
本研究通過調控膜曝氣生物膜反應器(MBfR)中的氧分壓,探究其對反擴散生物膜結構、空間分層及微生物協作機制的影響:
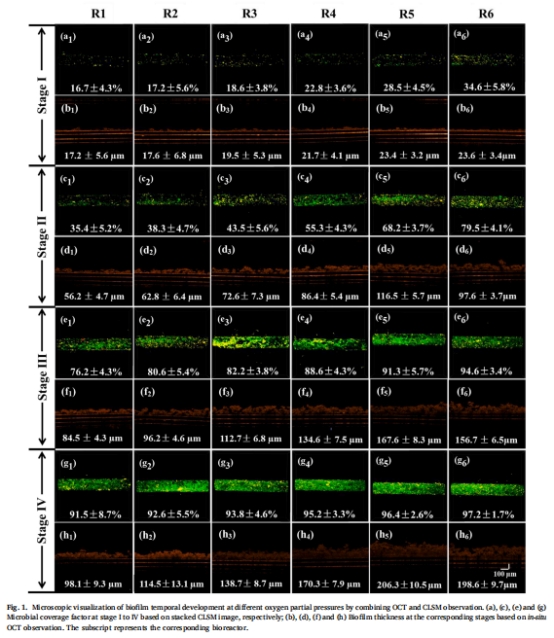
氧分壓調控:氧分壓(1.1–6.6 psig)顯著影響生物膜厚度(93–206 μm)和空間分層(圖1)。
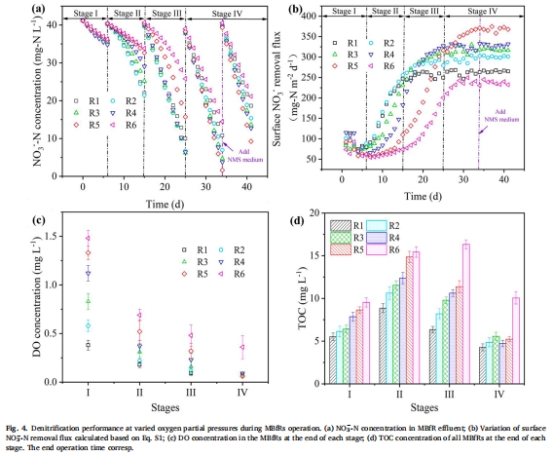
最佳性能:氧分壓5.5 psig(25% O?)時,生物膜形成最佳好氧/缺氧層平衡(好氧層120 μm),硝酸鹽去除通量達370 mg-N·m?2·d?1(圖4b)。
分層機制:
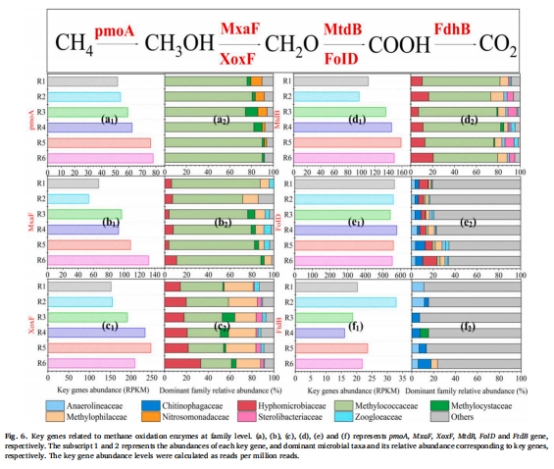
好氧層:富集好氧甲烷氧化菌(Methylococcaceae),完成CH?氧化(圖2, 圖6)。
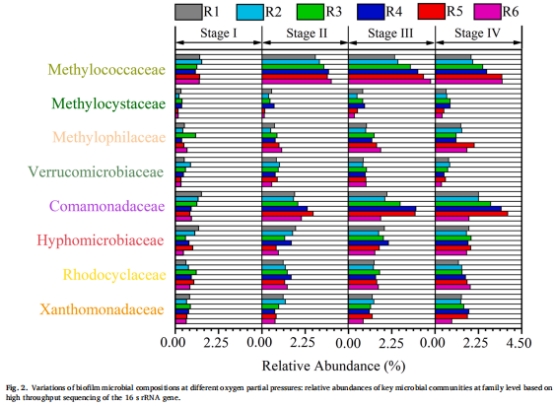
缺氧層:富集反硝化菌(Comamonadaceae),實現硝酸鹽還原(圖7)。

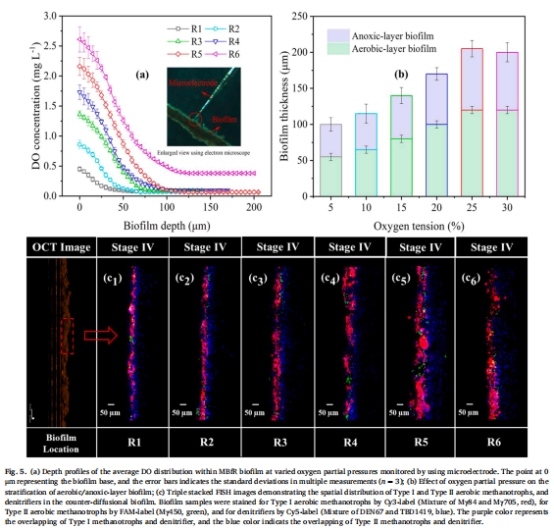
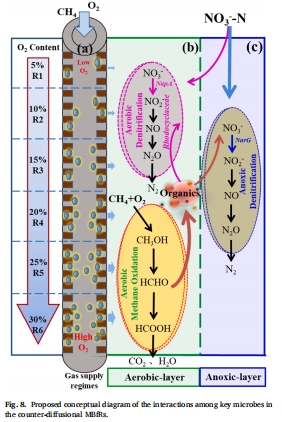
協同路徑:首次通過FISH(圖5c)和宏基因組(圖6-7)證實好氧甲烷氧化菌、好氧反硝化菌(Rhodocyclaceae)和缺氧反硝化菌的三元協作機制(圖8)。
研究目的
揭示氧分壓影響:闡明氧分壓如何調控反擴散生物膜的發育、空間分層及功能微生物分布。
解析協同機制:明確好氧甲烷氧化耦合反硝化(AME-D)過程中微生物的協作路徑。
優化工藝參數:確定最佳氧分壓以提升硝酸鹽去除效率及甲烷利用效率。
研究思路
采用 “多組平行反應器→原位表征→多組學驗證”策略:
反應器設計:
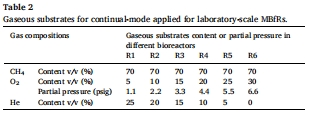
構建6組MBfR,施加梯度氧分壓(1.1–6.6 psig),通入CH?/O?/He混合氣(表2)。
監測硝酸鹽去除通量、溶解氧(DO)及TOC變化(圖4)。
生物膜原位表征:
OCT+CLSM:動態觀測生物膜厚度、覆蓋率(圖1)。
微電極:測量生物膜內DO梯度(Unisense電極,圖5a)。
FISH:定位好氧甲烷氧化菌(紅色)與反硝化菌(藍色)的空間分布(圖5c)。
多組學分析:
16S rRNA測序:分析微生物群落結構(圖2)。
宏基因組:鑒定甲烷氧化(pmoA, mxaF)和反硝化功能基因(narG, napA)(圖6-7)。
關鍵數據及研究意義
1. 生物膜結構與動態發育(圖1)
數據:
氧分壓5.5 psig時生物膜最厚(206.2±13.4 μm),覆蓋率>91%。
高氧分壓(6.6 psig)導致生物膜顆粒狀聚集(減少氧暴露)。
意義:證實氧分壓是調控生物膜形態的關鍵參數,為優化生物膜厚度提供依據。
2. 微生物群落演替(圖2)
數據:
好氧甲烷氧化菌(Methylococcaceae)相對豐度隨氧分壓升高而增加(R5: 36.7%)。
反硝化菌(Comamonadaceae)在5.5 psig時豐度最高(21.5%)。
意義:氧分壓通過調控功能菌豐度直接影響AME-D效率。
3. EPS組成變化(圖3)
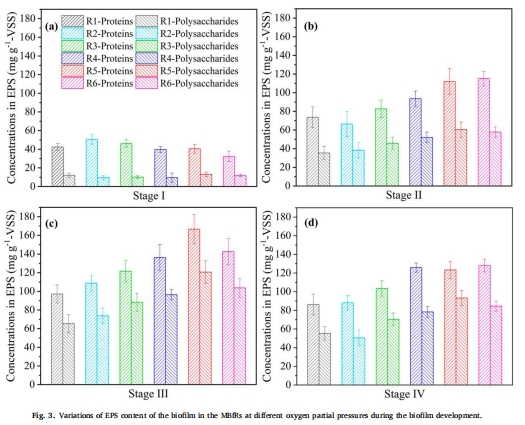
數據:
蛋白質和多糖含量隨氧分壓升高而增加(R5: 蛋白45.2 mg/gVSS,多糖38.7 mg/gVSS)。
三維熒光顯示色氨酸類物質(Peak A)為主要EPS組分。
意義:EPS增強生物膜結構穩定性,支持微生物在高壓氧環境下的存活。
4. 硝酸鹽去除性能(圖4)
數據:
氧分壓5.5 psig時硝酸鹽去除通量最高(370 mg-N·m?2·d?1),較1.1 psig提升45%。
DO>0.36 mg/L(6.6 psig)抑制反硝化活性。
意義:確立最佳氧分壓操作窗口(5.5 psig),避免氧抑制并最大化脫氮效率。
5. 空間分層與微生物分布(圖5)
數據:
FISH顯示好氧甲烷氧化菌富集于膜表面(0–120 μm),反硝化菌分布于深層(>120 μm)。
Rhodocyclaceae(好氧反硝化菌)在好氧層占比達15.3%(圖5c)。
意義:揭示生物膜分區代謝機制——好氧層氧化CH?,缺氧層進行反硝化。
Unisense微電極數據的專項解讀
技術原理
Unisense微電極(OX-10型)通過10 μm尖端原位測量生物膜內DO梯度:
高分辨率:以5 μm步進掃描,精度±0.05 mg/L。
無擾動:避免破壞生物膜原始結構。
核心發現(圖5a)
DO梯度特征:
膜界面(0 μm)DO最高(2.75 mg/L @6.6 psig),隨深度增加呈指數下降。
缺氧層起始深度:120 μm(5.5 psig)→ 55 μm(1.1 psig)。
分層閾值:
DO<0.5 mg/L定義為缺氧層(反硝化活躍區)。
5.5 psig時缺氧層厚度占比達43%(88.6 μm/206.2 μm)。
研究意義
機制驗證:
首次原位證實反擴散生物膜內存在嚴格的好氧/缺氧分區(圖5a)。
解釋為何5.5 psig性能最優:好氧層厚度(120 μm)足以支持CH?氧化,同時保證缺氧層完全耗盡DO(最低0.07 mg/L)。
工藝優化:
DO梯度數據指導氧分壓設定——維持好氧層DO 1.5–2.0 mg/L(對應5.5 psig),避免深層氧殘留抑制反硝化。
模型校準:
提供生物膜內氧傳質系數(如擴散通量2.8×10?? mol·m?2·s?1),用于預測分區邊界。
結論
氧分壓的核心作用:5.5 psig為最佳值,平衡生物膜好氧/缺氧層比例,實現最高脫氮效率。
生物膜分區機制:好氧層(Methylococcaceae)完成CH?氧化,缺氧層(Comamonadaceae)進行反硝化,Rhodocyclaceae在好氧層介導好氧反硝化。
工程啟示:MBfR可通過調控氧分壓優化生物膜結構,適用于低碳氮比廢水處理。
總結:Unisense微電極通過原位解析生物膜微環境氧梯度,為反擴散生物膜的分區代謝理論提供了直接證據,并為MBfR的氧分壓優化提供了精準調控依據。