熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Natural hydrogen gas and engineered microalgae prevent acute lung injury in sepsis
天然氣和工程微藻可預防膿毒癥中的急性肺損傷
來源:Materials Today Bio 28 (2024) 101247
1. 摘要核心內容
本研究通過多組學分析(磷酸化蛋白質組學、代謝組學、單細胞/空間轉錄組)發現氫氣治療膿毒癥肺損傷的靶點蛋白(Esam/Zo-1)和關鍵通路(鐵死亡、谷胱甘肽代謝)。基于此,構建了由小球藻(Chlorella vulgaris) 負載的二氫槲皮素-氨硼烷自組裝納米系統(DQB@C),實現了感染微環境響應性氫氣釋放。體內外實驗證實,DQB@C通過抑制炎癥因子、調節鐵死亡通路(Slc7a11↑/Cox2↓)和保護緊密連接蛋白,顯著減輕膿毒癥肺損傷及多器官功能障礙。
2. 研究目的
揭示氫氣治療機制:明確氫氣緩解膿毒癥肺損傷的分子靶點與通路。
解決氫氣臨床應用瓶頸:克服長期吸入氫氣對呼吸道的刺激問題。
開發新型納米遞送系統:利用微藻載體實現氫氣與天然藥物的協同遞送。
3. 研究思路
采用 “機制探索→藥物篩選→納米構建→功能驗證” 四步策略:
多組學分析:
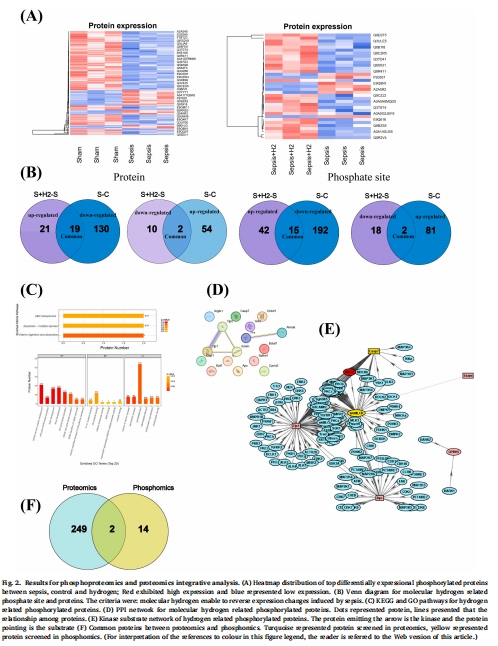
磷酸化蛋白質組學:鑒定CLP(盲腸結扎穿孔)膿毒癥小鼠模型經氫氣干預后的差異磷酸化蛋白(圖2)。
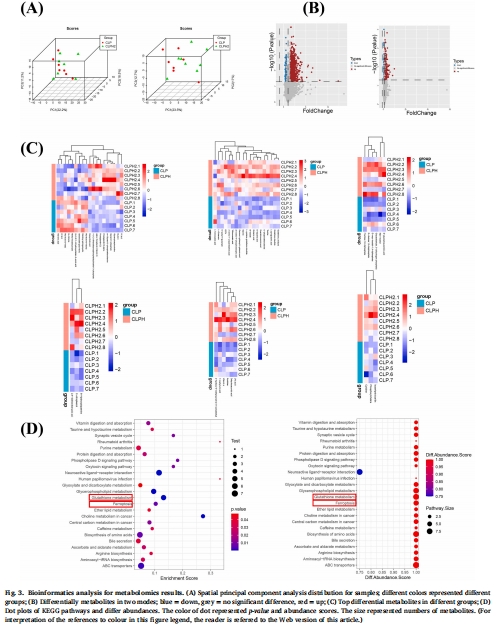
代謝組學:分析肺組織代謝通路變化(圖3)。
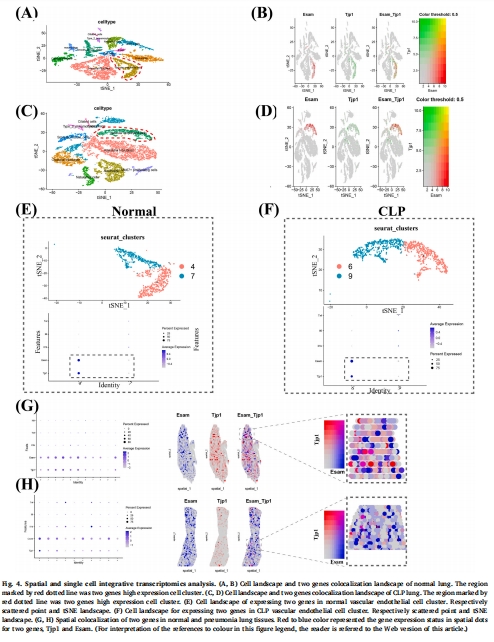
單細胞/空間轉錄組:定位靶基因(Esam/Zo-1)在肺細胞中的空間分布(圖4)。
候選藥物篩選:基于網絡藥理學篩選二氫槲皮素(DQ)為Esam/Zo-1調節劑。
納米系統構建:
自組裝DQB納米粒:疏水作用驅動DQ與氨硼烷(AB)組裝(粒徑168 nm)。
微藻負載:小球藻吸附DQB形成DQB@C(粒徑307.3 nm,Zeta電位-22 mV)(圖5A-B)。
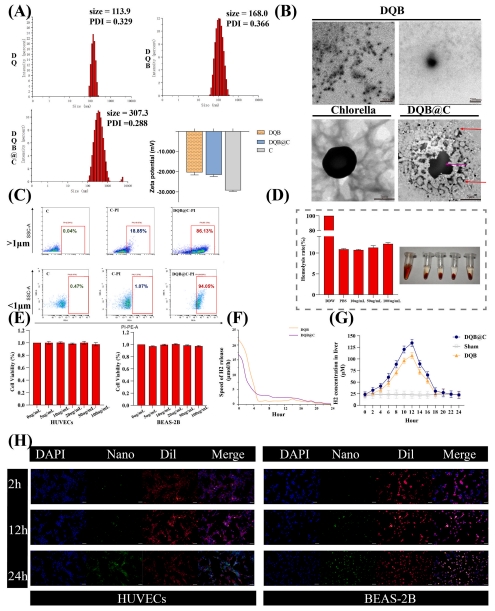

功能驗證:
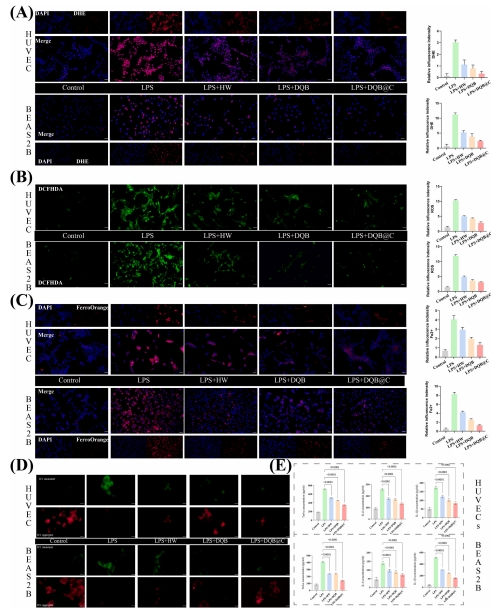
體外:抗炎、抗氧化、鐵死亡調控(圖6-7)。

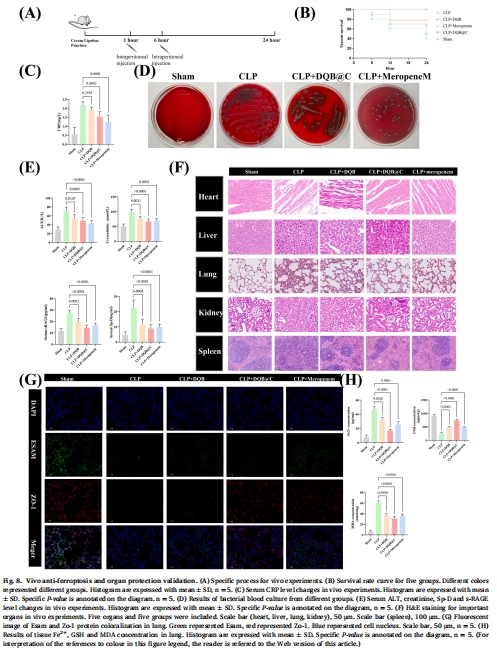
體內:生存率、器官保護、靶蛋白表達(圖8)。
4. 關鍵數據及研究意義
(1) 磷酸化蛋白質組學(圖2)
數據:
鑒定20個差異磷酸化位點(如Zo-1的S1VAS1S1QPAKPTK、Esam的MGAVPVMVPAQS1QAGS1LV)。
氫氣逆轉膿毒癥導致的Zo-1磷酸化升高和Esam磷酸化降低。
意義:首次明確緊密連接蛋白磷酸化是氫氣治療膿毒癥肺損傷的核心機制,為靶向干預提供依據。
(2) 代謝組學(圖3)
數據:
膿毒癥組谷胱甘肽代謝紊亂,鐵死亡通路激活(p<0.05)。
氫氣干預恢復代謝穩態。
意義:揭示氫氣通過調節氧化應激與鐵死亡發揮保護作用。
(3) 單細胞/空間轉錄組(圖4)
數據:
Esam/Zo-1共表達于肺血管內皮細胞(圖4E-F)。
膿毒癥中二者表達下調,與炎癥因子(Tnf/Il-6)呈負相關(圖4G-H)。
意義:從空間層面定位靶點,證實內皮屏障破壞是肺損傷的關鍵環節。
(4) DQB@C納米系統表征(圖5)
數據:
小球藻改善DQB分散性(TEM顯示聚集減少)。
pH 6.5感染微環境下持續釋放氫氣(圖5F)。
細胞攝取效率高(12 h內熒光標記納米粒內化,圖5H)。
意義:微藻載體解決自組裝納米粒穩定性問題,實現微環境響應性釋氫。
(5) 體內外功能驗證
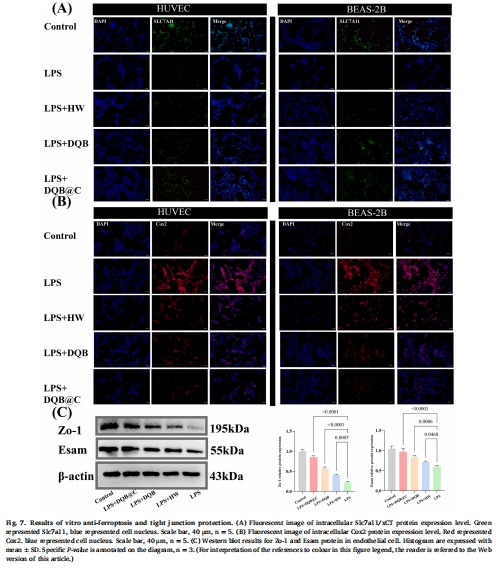
體外(圖6-7):
DQB@C降低ROS、Fe2?積累(圖6A-C),保護線粒體功能(圖6D),抑制IL-6/TNF-α分泌(圖6E)。
上調Slc7a11(鐵死亡抑制蛋白)、下調Cox2(圖7A-B),增強Zo-1/Esam表達(圖7C)。
體內(圖8):
生存率:DQB@C組24 h生存率達70%(vs CLP組40%)(圖8B)。
器官保護:降低血清CRP、ALT、肌酐水平(圖8C,E),修復肺組織病理損傷(圖8F)。
靶點調控:恢復肺組織Zo-1/Esam蛋白表達(圖8G),抑制鐵死亡(GSH↑/MDA↓/Fe2?↓)(圖8H)。
5. 核心結論
機制創新:氫氣通過調節Esam/Zo-1磷酸化和鐵死亡通路緩解膿毒癥肺損傷。
納米系統優勢:DQB@C實現:
精準釋氫:感染微環境(pH 6.5)觸發氨硼烷水解產氫。
協同治療:二氫槲皮素增強抗氧化/抗炎,小球藻提高生物相容性。
治療效能:DQB@C療效媲美美羅培南(抗生素對照),且兼具多器官保護功能。
6. 丹麥Unisense電極的研究意義
(1) 技術原理
電極型號:REF321 Ag/AgCl微電極(尖端直徑10 μm)。
校準方法:pH 4.0/7.0/9.0/11.0標準液校準,精度±0.1單位。
原位測量:小鼠腸道樣本固定于瓊脂層,電極微操縱定位(方法部分)。
(2) 關鍵應用
精準量化微環境:證實膿毒癥腸道/感染灶呈酸性微環境(pH≈6.5),為氨硼烷的pH響應性釋氫提供理論依據。
動態監測潛力:支持活體組織實時pH追蹤(本研究未開展,但技術可行)。
(3) 研究價值
空間分辨率優勢:
微尺度定位:避免組織勻漿導致的區室化pH信息丟失。
機制關聯橋梁:將“感染→微環境酸化→納米系統響應釋氫”鏈條實證化,推動精準給藥系統設計。
圖表索引
圖2:磷酸化蛋白質組學分析(差異蛋白/通路/PPI網絡)
圖3:代謝組學結果(PCA/差異代謝物/通路富集)
圖4:單細胞與空間轉錄組(靶基因定位/共表達)
圖5:DQB@C納米系統表征(粒徑/Zeta電位/TEM/釋氫曲線)
圖6:體外抗炎/抗氧化驗證(ROS/Fe2?/線粒體/炎癥因子)
圖7:體外靶蛋白調控(Slc7a11/Cox2/Zo-1/Esam)
圖8:體內療效(生存率/器官功能/病理/靶蛋白表達)
局限與展望:DQB@C抗菌能力弱于抗生素(美羅培南),未來需整合抗菌組分提升抗感染效能。