熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Tissue oxygen partial pressure as a viability metric for ex vivo brain tissue slices
組織氧分壓作為離體腦組織切片的活力指標
來源:Journal of Neuroscience Methods 396 (2023) 109932
摘要內容
本研究提出了一種基于組織氧消耗率的離體腦切片存活度評估新方法。通過測量小鼠皮層腦切片中的最低氧分壓(pO????),結合氧消耗率計算和2,3,5-三苯基氯化四氮唑(TTC)染色驗證,發現:
pO????與氧消耗率強相關(無鎂人工腦脊液(aCSF)中R2=49.7%,正常aCSF中R2=42.1%),表明pO????可作為氧消耗的簡易替代指標。
pO????與TTC染色一致性高:氧消耗率越高(組織越健康),TTC染色越深(圖4a);pO????越低,TTC染色越深(圖4b)。
癲癇樣事件(SLE)頻率與氧消耗率正相關(R2=44.8%),而傳統指標(如SLE振幅)與存活度無關。
研究目的
解決離體腦切片實驗中組織存活度評估的可靠性問題:
驗證pO????能否作為簡單、直接的存活度指標。
對比pO????與傳統電生理指標(如SLE振幅)的優劣。
探索氧消耗與神經活動(如SLE)的關系。
研究思路
模型設計:
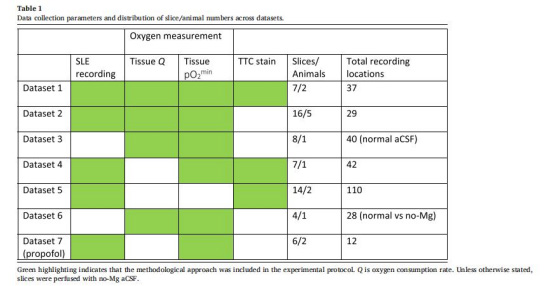
使用400μm厚小鼠皮層腦切片,分為無鎂aCSF(誘導SLE活動)和正常aCSF(靜息狀態)兩組。
通過丹麥Unisense微電極(50μm尖端)測量切片深度氧分壓。
多維度驗證:
氧消耗率(Q):基于Fick擴散-消耗模型計算。
pO????:直接讀取氧分壓剖面最低值。
TTC染色:定性評估組織活性。
SLE活動:記錄事件振幅、頻率。
統計分析:
線性回歸分析pO????與Q、TTC、SLE參數的關聯。
對比不同條件(如aCSF類型、流速)對pO????的影響。
測量數據、來源圖表及研究意義
pO????與氧消耗率相關性
來源:圖3a-b(無鎂/正常aCSF數據)
pO????是氧消耗率的可靠代理指標(無需復雜計算),簡化存活度評估流程。
氧參數與TTC染色的關聯
來源:圖4a-b(TTC vs. Q / pO????)
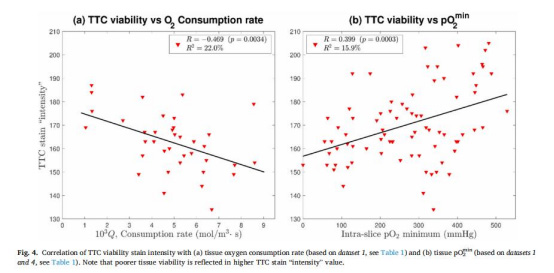
意義:直接證明pO????越低(或Q越高),組織越健康,驗證其作為生物學指標的效度。
SLE活動與氧消耗的關系
來源:無鎂aCSF數據集
意義:SLE頻率(而非振幅)與氧消耗正相關,挑戰傳統電生理指標作為存活度標準的可靠性。
流速對pO????的影響
來源:流速實驗
意義:低流速(≤2 mL/min)顯著降低pO????,提示實驗需控制aCSF流速≥10 mL/min以減少干擾。
丙泊酚干預實驗
來源:數據集7(表1)
意義:pO????可預測藥物效應(如丙泊酚抑制SLE的效果與初始pO????相關),突顯其在實驗設計中的實用性。
結論
pO????是理想存活度指標:
與氧消耗率、TTC染色強相關,且測量簡便(無需全剖面掃描)。
健康組織標準:無鎂aCSF中pO???? ≈0–50 mmHg;正常aCSF中pO???? ≈150–200 mmHg。
傳統電生理指標不可靠:
SLE振幅與存活度無關,頻率雖相關但模型依賴性高(僅適用于無鎂aCSF)。
應用價值:
通過預實驗測量pO????,可篩選健康切片或匹配實驗組間存活度,減少結果偏差(如丙泊酚實驗)。
丹麥Unisense微電極測量數據的詳細解讀
技術原理與操作
設備:Clark式氧電極(Unisense,50μm尖端),極化校準后插入腦片不同深度(圖1e)。
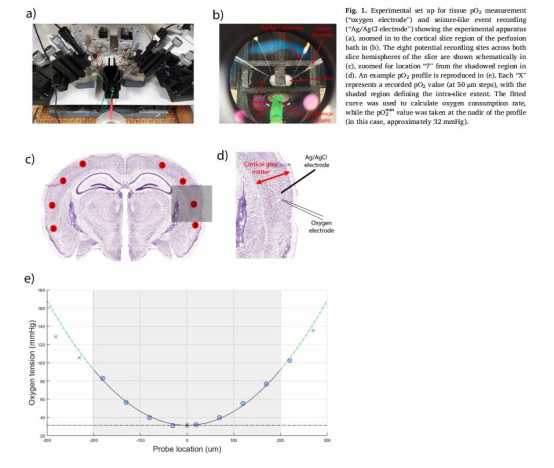
關鍵步驟:
校準:空氣中(~155 mmHg)和0.1 M抗壞血酸鈉(0 mmHg)兩點校準。
測量模式:
全剖面掃描:每50μm步進,計算氧消耗率Q(Fick模型)。
pO????快速讀取:定位最低氧分壓位置(通常深度200μm)。
研究意義
量化組織代謝狀態:
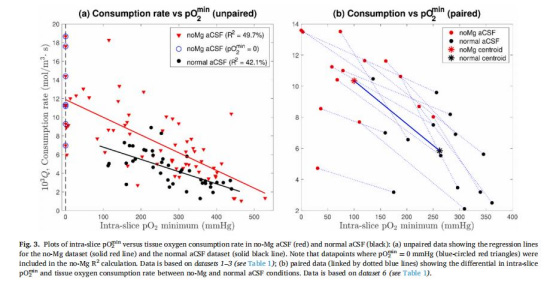
pO????直接反映局部氧需求:健康組織耗氧高→pO????降低(圖3a)。
無鎂aCSF中pO????比正常aCSF低162 mmHg(圖3b),證明神經活動顯著增加代謝負擔。
解決傳統方法缺陷:
電生理指標(如SLE振幅)受同步性等因素干擾,與存活度無顯著關聯;pO????提供客觀、定量的生物學標準。
TTC染色需終止實驗,而pO????支持實時、無損監測(圖4a-b)。
優化實驗設計:
揭示aCSF流速對氧供給的影響(流速≤2 mL/min時pO????下降22.7 mmHg/mL/min),指導流速設置(≥10 mL/min)。
提出ΔP = pO????? - pO????作為改進指標(R2提升至69.5%),消除表面氧分壓波動影響(公式4)。

應用場景擴展:
藥理研究:丙泊酚實驗中,初始pO????預測藥物抑制效果(R2=52%),避免存活度混雜因素。
空間異質性評估:多點測量揭示切片內存活度差異(如圖2a位置1 vs. 8),支持精準區域選擇。
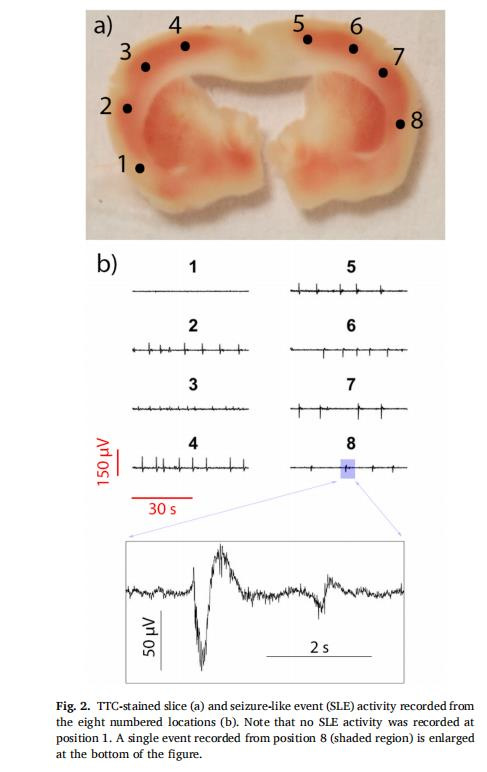
意義:證實
技術局限與建議
電極維護:玻璃尖端易損,需謹慎操作;壽命約12–18個月。
深度假設:默認pO????位于切片中點(200μm),實際可能因組織異質性偏移。
替代方案:熒光納米顆粒技術可空間連續成像,但成本較高。
核心貢獻:Unisense微電極首次將pO????確立為離體腦切片存活度的金標準,為神經科學研究提供高效、可靠的質控工具。