熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Matrix stiffness regulates osteoclast fate through integrin-dependent mechanotransduction
基質硬度通過整合素依賴性機械轉導調節破骨細胞的命運
來源:Bioactive Materials
一、摘要核心內容
本研究通過構建不同剛度(2.43–68.2 kPa)的GelMA水凝膠模擬骨微環境,首次提出基質剛度可精準調控破骨細胞命運:
剛度依賴性分化:隨基質剛度增加,破骨細胞形成增強(高剛度抑制整合素β3-RhoA-ROCK2-YAP力學傳導,激活NF-κB信號)。
前破骨細胞關鍵作用:中等剛度(17.5–44.6 kPa,類血管剛度)促進前破骨細胞分化(TRAP?單核細胞),抑制其融合為成熟破骨細胞,通過分泌PDGF-BB誘導血管生成和骨再生。
體內驗證:植入中等剛度水凝膠顯著促進小鼠股骨缺損的血管化和骨修復(圖6-7)。
二、研究目的
解決臨床瓶頸:克服骨質疏松治療中破骨細胞活性調控不精準的問題(如雙膦酸鹽致頜骨壞死)。
探索力學調控替代策略:驗證基質剛度是否可作為獨立因素調控破骨細胞分化,避免外源因子副作用。
開發骨修復新材料:基于剛度優化設計促骨再生的水凝膠植入物。
三、研究思路
材料構建:
調控GelMA濃度(10–30%)和紫外交聯時間(30–90秒)制備不同剛度水凝膠(圖1a-d)。
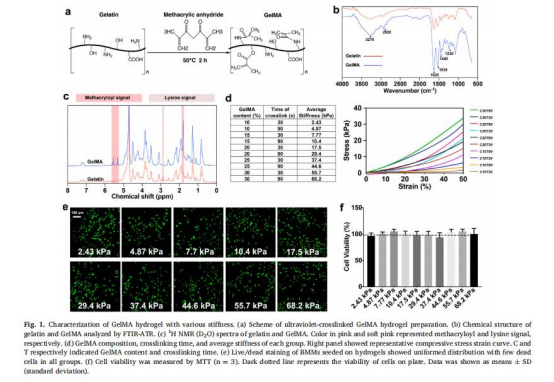
驗證生物相容性(圖1e-f)。
體外機制:
剛度對破骨細胞分化的影響(TRAP染色、骨吸收實驗,圖2)。
力學傳導通路分析(整合素β3-RhoA-ROCK2-YAP信號,圖3-4)。
體內驗證:
小鼠股骨缺損模型植入水凝膠(圖6a)。
評估血管生成(微血管造影、免疫熒光)、骨再生(μCT、H&E染色)及力學信號(YAP定位,圖5-7)。
剛度依賴性破骨細胞分化(圖2b-e)
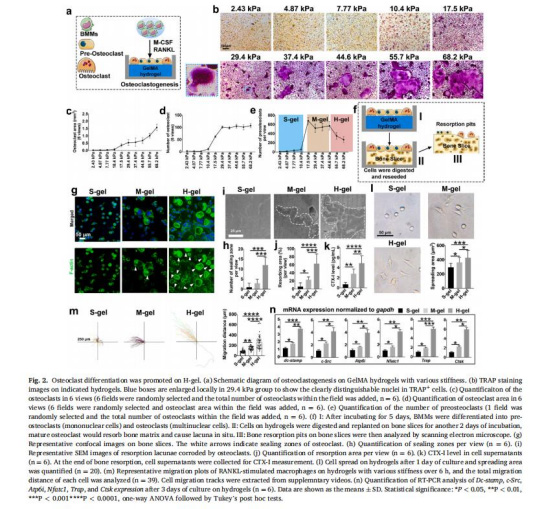
數據:高剛度組(68.2 kPa)的TRAP?多核破骨細胞數量較軟剛度組(2.43 kPa)增加3倍,骨吸收面積增加2.5倍(圖2j)。
意義:證實剛度是獨立于生化因子的破骨細胞分化調控因素,為骨質疏松治療提供新靶點。
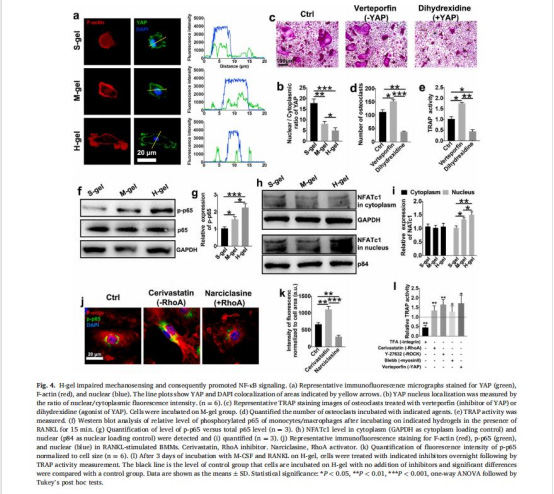
整合素β3-RhoA信號抑制(圖3a-g)
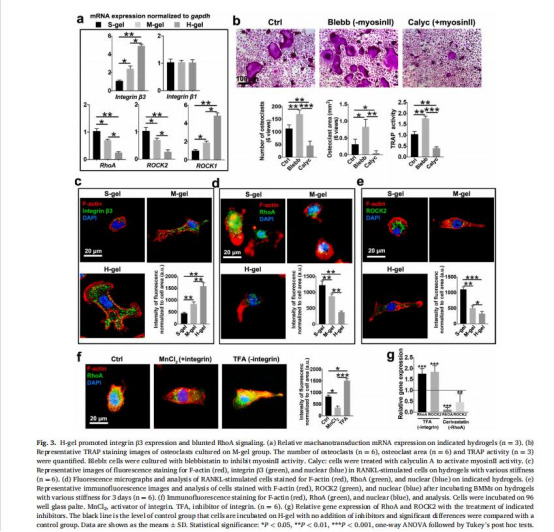
數據:高剛度組整合素β3表達升高40%,RhoA活性下降50%(圖3a,d)。
意義:揭示剛度通過整合素負調控RhoA-ROCK2通路,削弱力學傳導,促進NF-κB驅動的破骨細胞分化(圖4f-i)。
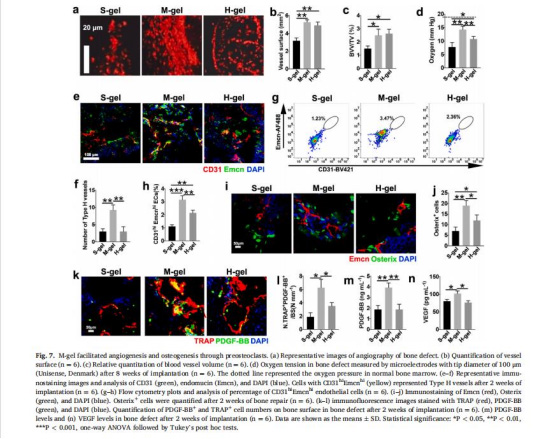
前破骨細胞促血管生成(圖7e-h)
數據:中等剛度組(29.4 kPa)CD31hiEmcnhi型H血管數量較軟/高剛度組增加2倍(圖7g),PDGF-BB分泌量提高80%(圖7m)。
意義:闡明前破骨細胞通過旁分泌PDGF-BB耦合血管生成與骨形成,為骨缺損修復提供新策略。
體內骨再生效果(圖6b-f)
數據:中等剛度組骨體積分數(BV/TV)較對照組提高70%,骨小梁數量(Tb.N)增加60%(圖6c-e)。
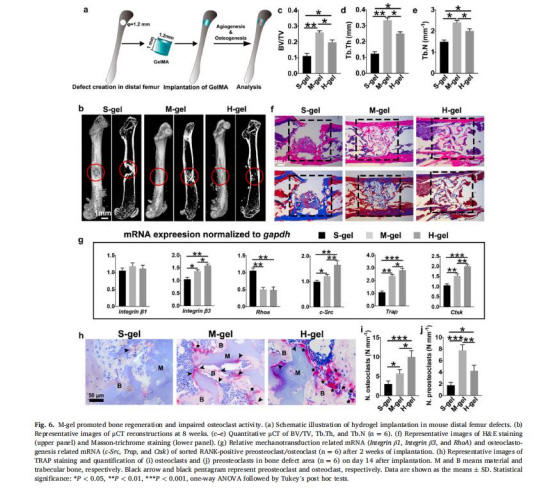
意義:驗證中等剛度水凝膠通過維持前破骨細胞狀態促進功能性骨再生。
五、丹麥Unisense電極測量數據的研究意義
檢測目標:
骨缺損區氧分壓動態監測:使用Unisense氧微電極(尖端直徑100 μm)實時測量缺損區氧張力(圖7d)。
關鍵發現與意義:
量化缺氧緩解效應:
中等剛度組(M-gel)氧分壓顯著高于軟/高剛度組(p<0.01),接近正常骨髓氧壓(虛線基準)。
意義:直接證明中等剛度通過促進功能性血管(CD31hiEmcnhi型H血管)改善骨缺損缺氧微環境。
揭示血管功能差異:
盡管高剛度組血管體積與中等剛度組相似(圖7c),但其氧輸送效率更低(氧分壓下降30%)。
意義:凸顯CD31hiEmcnhi型H血管的高效氧轉運能力,解釋中等剛度組促骨再生優勢。
技術優勢:
高時空分辨率:實時捕捉局部氧動態,克服傳統終點檢測的局限性。
在體微環境模擬:精準反映骨再生過程中的氧代謝變化,指導植入物設計。
六、結論
力學傳導核心機制:基質剛度通過整合素β3-RhoA-ROCK2-YAP通路負調控力學信號,激活NF-κB促進破骨細胞分化(圖8)。
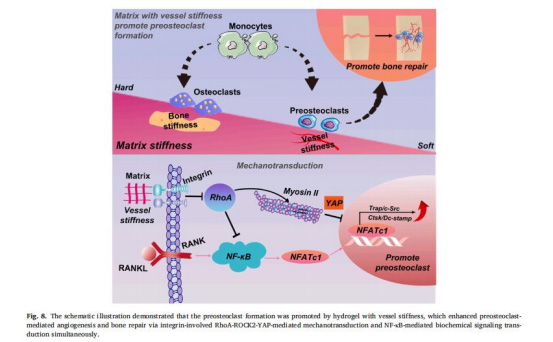
治療策略創新:中等剛度(類血管剛度)可維持前破骨細胞狀態,通過PDGF-BB分泌促進血管-成骨耦聯,實現精準骨再生。
臨床轉化潛力:基于剛度優化的水凝膠植入物為骨質疏松和骨缺損提供安全、有效的力學調控方案。