熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Self-oxygenation of engineered living tissues orchestrates osteogenic commitment of mesenchymal stem cells
工程化活組織的自氧合協(xié)調(diào)間充質(zhì)干細(xì)胞的成骨承諾
來源:Biomaterials 300 (2023) 122179
一、摘要核心內(nèi)容
本研究開發(fā)了一種基于過氧化鈣(CPO)的產(chǎn)氧微顆粒(OMPs),并將其整合到甲基丙烯酰化明膠(GelMA)水凝膠中,用于改善缺氧微環(huán)境下人骨髓間充質(zhì)干細(xì)胞(hMSCs)的成骨分化。核心發(fā)現(xiàn)包括:
OMPs的持續(xù)供氧能力:通過聚己內(nèi)酯(PCL)包封CPO實(shí)現(xiàn)長效氧釋放(14天),緩解缺氧壓力。
缺氧條件下的成骨增強(qiáng):OMP水凝膠在常氧(5%O?)和嚴(yán)重缺氧(<0.2%O?)環(huán)境下均顯著提升hMSCs的成骨標(biāo)志物表達(dá)(ALP、OCN、OPN)和鈣沉積。
協(xié)同效應(yīng):OMPs與成骨誘導(dǎo)性硅酸鹽納米顆粒(SNPs)聯(lián)用(SNP/OMP水凝膠)在體內(nèi)促進(jìn)血管生成和宿主細(xì)胞浸潤,加速骨組織再生。
機(jī)制解析:RNA測序表明OMPs通過上調(diào)BMP6、CTNNB1等基因激活成骨通路,且缺氧環(huán)境增強(qiáng)其促分化效應(yīng)。
二、研究目的
解決缺氧問題:克服大尺寸骨移植物因缺氧導(dǎo)致的細(xì)胞死亡和再生失敗。
優(yōu)化材料設(shè)計(jì):開發(fā)可控釋氧的OMPs,驗(yàn)證其對(duì)hMSCs成骨分化的影響。
探索協(xié)同機(jī)制:比較OMPs、SNPs及兩者聯(lián)用對(duì)成骨分化的調(diào)控作用。
驗(yàn)證臨床應(yīng)用潛力:通過皮下植入模型評(píng)估材料降解、血管生成及骨形成能力。
三、研究思路
材料制備:
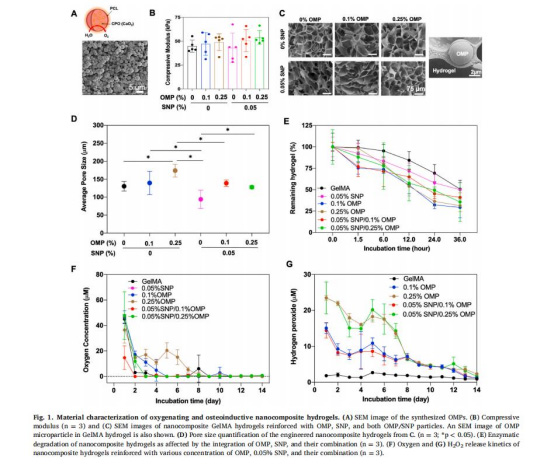
構(gòu)建三種GelMA水凝膠:OMP水凝膠(0.25%OMP)、SNP水凝膠(0.05%SNP)、SNP/OMP水凝膠(0.05%SNP+0.25%OMP)。
體外實(shí)驗(yàn):
力學(xué)與降解:測試水凝膠壓縮模量(45-55 kPa,圖1B)、孔隙結(jié)構(gòu)(SEM,圖1C-D)及酶降解動(dòng)力學(xué)(圖1E)。
氧/過氧化氫釋放:Unisense電極監(jiān)測氧濃度(圖1F)和H?O?水平(圖1G)。
細(xì)胞行為:在常氧/缺氧下評(píng)估hMSCs存活、增殖(Live/Dead染色,圖2)及成骨分化(ALP活性、鈣沉積、基因表達(dá),圖3)。
體內(nèi)驗(yàn)證:
大鼠皮下植入水凝膠,分析宿主細(xì)胞浸潤、血管生成(CD31+染色,圖5)及免疫反應(yīng)(CD86+/CD206+巨噬細(xì)胞)。
四、測量數(shù)據(jù)及研究意義
材料表征數(shù)據(jù)(圖1)
O?釋放曲線(圖1F):OMP水凝膠持續(xù)釋氧14天(0.31μM),而SNP/OMP組因SNP吸附O?導(dǎo)致釋氧量降低(<0.2μM)。
意義:揭示SNPs的氧氣吸附特性,指導(dǎo)復(fù)合材料設(shè)計(jì)以優(yōu)化供氧。
H?O?釋放(圖1G):OMP組H?O?濃度<30μM(低于細(xì)胞毒性閾值)。
意義:證實(shí)PCL包封有效控制CPO水解,避免氧化損傷。
細(xì)胞存活與分化(圖2-3)

缺氧下存活率(圖2D):SNP組細(xì)胞存活率<50%,而OMP/SNP-OMP組>90%。
意義:OMPs通過供氧逆轉(zhuǎn)SNPs在缺氧下的細(xì)胞毒性。
ALP活性(圖3B):缺氧下SNP/OMP組ALP活性比SNP組高3倍。
意義:OMPs與SNPs協(xié)同增強(qiáng)早期成骨分化。
鈣沉積(圖3I):SNP/OMP組在缺氧下鈣沉積量顯著高于SNP組。
意義:自供氧環(huán)境促進(jìn)基質(zhì)礦化。
基因調(diào)控(圖4)
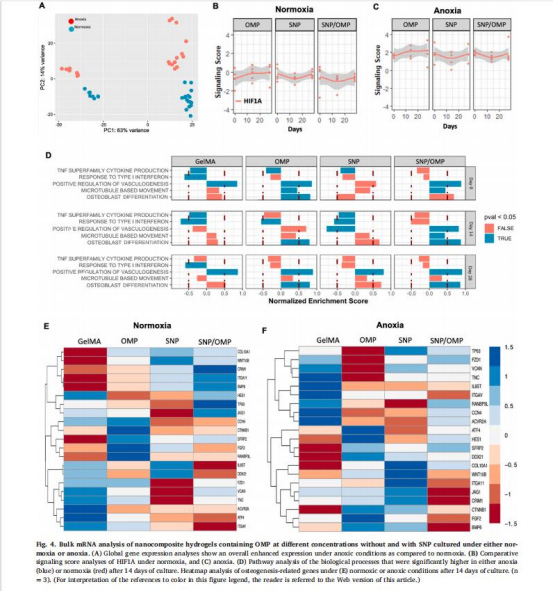
RNA測序(圖4E-F):缺氧下OMP組上調(diào)BMP6、CTNNB1(Wnt通路)、HES1等成骨基因。
意義:闡明氧氣通過激活BMP/Wnt通路驅(qū)動(dòng)成骨分化。
體內(nèi)血管化(圖5)
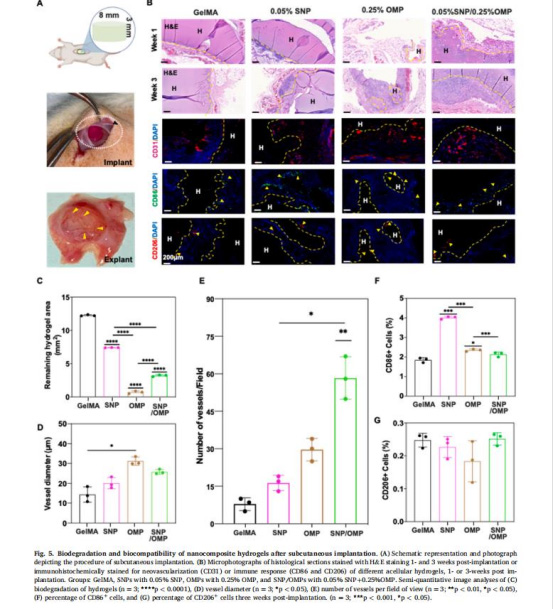
CD31+血管密度(圖5E):SNP/OMP組血管數(shù)量顯著高于其他組。
意義:OMPs加速移植物血管化,縮短植入體缺氧期。
五、丹麥Unisense電極測量數(shù)據(jù)的研究意義
檢測目標(biāo):
溶解氧濃度:使用Unisense Opto-F1光纖氧傳感器監(jiān)測水凝膠中O?釋放動(dòng)力學(xué)(方法2.5.3)。
校準(zhǔn)方法:兩點(diǎn)校準(zhǔn)(空氣飽和PBS vs.氮?dú)饷撗鮌BS)確保數(shù)據(jù)可靠性。
關(guān)鍵發(fā)現(xiàn)與意義:
精準(zhǔn)量化釋氧性能:
首次證實(shí)SNPs吸附氧氣(SNP/OMP組釋氧量<0.2μM),揭示材料交互作用對(duì)供氧的影響(圖1F)。
意義:為優(yōu)化復(fù)合材料的氧氣控釋策略提供直接實(shí)驗(yàn)證據(jù)。
支持細(xì)胞代謝需求:
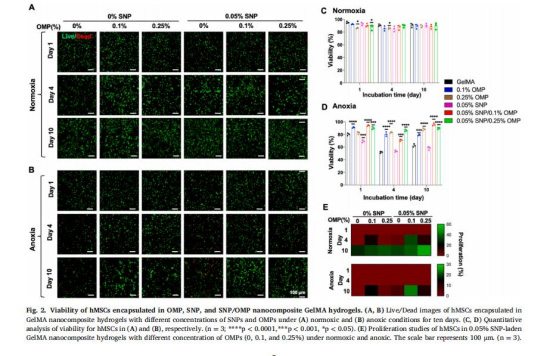
OMP組維持0.31μM O?達(dá)14天,滿足hMSCs在缺氧下的存活與分化需求(圖2D,3B)。
意義:明確OMPs作為“人工線粒體”的功能,為臨床大尺寸移植物設(shè)計(jì)提供參數(shù)依據(jù)。
技術(shù)優(yōu)勢:
高時(shí)空分辨率:實(shí)時(shí)動(dòng)態(tài)監(jiān)測局部氧濃度變化,克服傳統(tǒng)終點(diǎn)檢測的局限性。
意義:建立標(biāo)準(zhǔn)化評(píng)估體系,推動(dòng)產(chǎn)氧材料在組織工程中的應(yīng)用。
六、結(jié)論
材料創(chuàng)新:CPO-PCL微顆粒實(shí)現(xiàn)長效、可控供氧,H?O?釋放低于毒性閾值。
成骨增強(qiáng)機(jī)制:
OMPs通過上調(diào)BMP6/CTNNB1通路促進(jìn)成骨分化,缺氧環(huán)境進(jìn)一步放大該效應(yīng)。
SNPs在缺氧下抑制細(xì)胞活性,而OMPs逆轉(zhuǎn)此效應(yīng)并協(xié)同增強(qiáng)礦化。
臨床轉(zhuǎn)化價(jià)值:
SNP/OMP水凝膠在體內(nèi)促進(jìn)血管生成(CD31+↑)和宿主整合,加速骨再生。
縮短移植物預(yù)血管化周期,為臨界骨缺損修復(fù)提供新策略。