熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Improved Photodynamic Therapy Based on Glutaminase Blockage via Tumor Membrane Coated CB-839/IR-780 Nanoparticles
基于腫瘤膜包覆的CB-839IR-780納米顆粒改進的谷氨酰胺酶抑制的光動力療法
來源:Small (2023, 2305174)
一、摘要核心內容
本研究開發了一種新型納米顆粒 IRCB@M,通過雙重機制增強光動力療法(PDT)效果:
抑制谷氨酰胺代謝:阻斷谷氨酰胺酶(GLS)活性,減少腫瘤細胞耗氧(緩解缺氧)并降低還原性物質(NADPH、GSH)水平。
協同增效PDT:光敏劑IR-780在富氧環境下產生更多活性氧(ROS),同時還原性物質的減少使ROS更有效殺傷腫瘤細胞。
靶向遞送系統:腫瘤細胞膜包裹的納米顆粒(IRCB@M)實現同源靶向,增強腫瘤富集并降低生物毒性。
二、研究目的
克服PDT瓶頸:解決腫瘤微環境(TME)缺氧和還原性物質過表達對PDT療效的限制。
開發雙機制納米平臺:通過阻斷谷氨酰胺代謝同時緩解缺氧并降低抗氧化能力,放大ROS殺傷效應。
驗證體內外療效:評估IRCB@M在胃癌模型中的靶向性、安全性及抗腫瘤效果。
三、研究思路
材料設計:
自組裝IR-780(光敏劑)與CB-839(GLS抑制劑)形成納米核心(IRCB)。
包裹AGS胃癌細胞膜(IRCB@M)實現同源靶向和免疫逃逸。
機制驗證:
體外:檢測GLS活性、氧消耗、還原物質(NADPH/GSH)水平及ROS生成(圖2-4)。
體內:通過近紅外成像評估腫瘤靶向性,測量腫瘤體積/重量驗證療效(圖5)。
療效與安全性:
評估PDT對腫瘤生長的抑制(CCK-8、活/死細胞染色)。
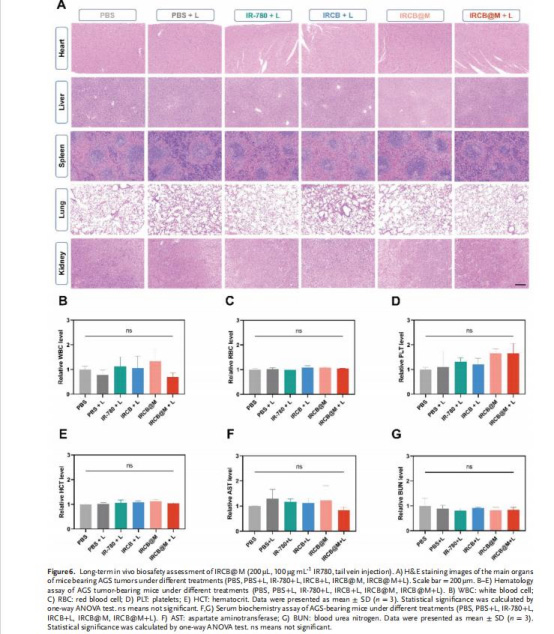
通過血液生化及器官H&E染色驗證生物安全性(圖6)。
四、測量數據及研究意義
GLS活性抑制(圖2C-D)
數據:IRCB@M處理6小時后,GLS活性降至對照組的40%(p<0.0001)。
意義:證實CB-839有效阻斷谷氨酰胺代謝,為后續缺氧緩解和還原物質減少奠定基礎。
缺氧緩解與氧消耗降低(圖2G-H)
數據:
溶解氧電極顯示IRCB@M組氧消耗率降低50%(vs. PBS組)。
HIF-1α表達下降70%(免疫熒光染色)。
意義:抑制GLS減少線粒體耗氧,緩解TME缺氧,增強PDT的氧依賴性ROS生成。
還原物質水平下降(圖3B-D)
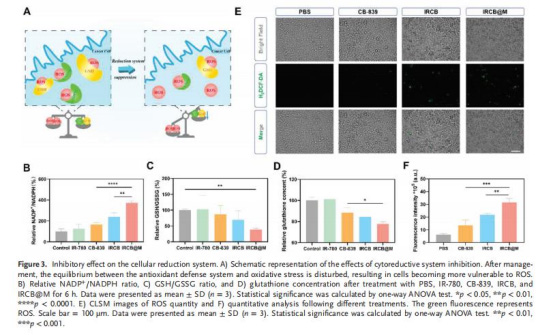
數據:
NADP?/NADPH比率增加2.5倍。
GSH/GSSG比率下降60%,總谷胱甘肽減少45%。
意義:削弱腫瘤抗氧化防御系統,延長ROS半衰期并增強細胞毒性。
ROS生成與細胞殺傷(圖4C-F)
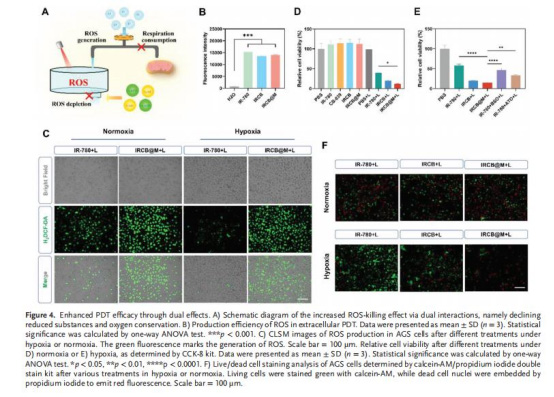
數據:
IRCB@M+激光組ROS熒光強度為IR-780組的2.3倍(p<0.001)。
缺氧條件下細胞存活率降至20%(vs. 57.6% in IR-780組)。
意義:雙重機制顯著提升PDT效率,尤其在缺氧環境中。
體內抗腫瘤效果(圖5B-C)
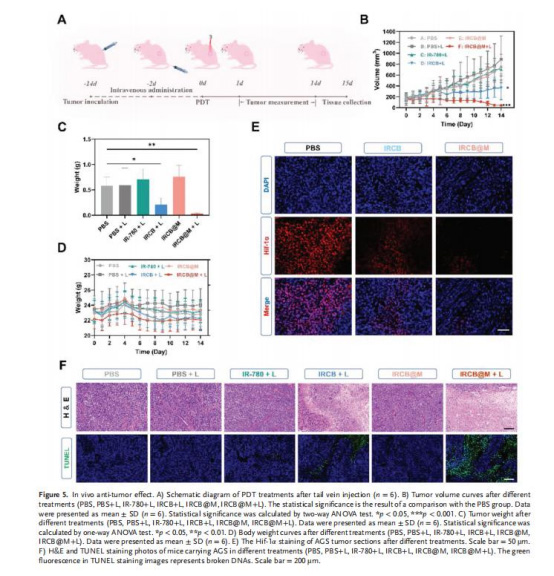
數據:IRCB@M+激光組腫瘤體積縮小85%,重量減少80%(vs. PBS組)。
意義:同源靶向納米顆粒實現高效腫瘤抑制,且無體重下降(圖5D)。
五、丹麥Unisense電極測量數據的研究意義
檢測目標:
實時溶解氧監測:使用Unisense氧微電極(OX-NP)在封閉系統中動態追蹤細胞培養液的氧分壓變化(圖2G)。
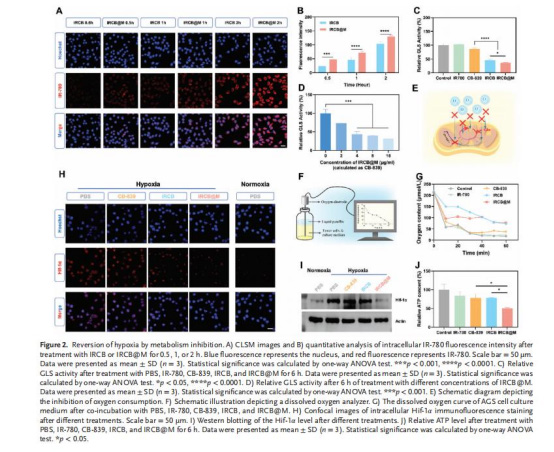
關鍵發現與意義:
量化氧節約效應:
IRCB@M處理組氧消耗速率顯著低于對照組(斜率下降50%),直接證明GLS阻斷減少線粒體呼吸耗氧。
意義:為“代謝干預緩解缺氧”提供實時動力學證據,克服傳統終點檢測的局限性。
驗證代謝干預效果:
對比單藥(CB-839)與納米顆粒(IRCB@M),后者因增強細胞攝取進一步降低氧消耗率。
意義:凸顯納米載體提升藥物遞送效率的優勢。
技術優勢:
高時空分辨率:每秒記錄氧分壓,捕捉藥物添加后的瞬時變化(如CB-839注入后氧下降速率驟減)。
封閉系統模擬:精準模擬腫瘤毛細血管的擴散受限環境,反映真實TME中氧動態。
意義:為優化PDT增敏策略提供可靠工具,指導臨床轉化。
六、結論
雙機制協同增效:
GLS阻斷通過減少耗氧(緩解缺氧)和降低NADPH/GSH(削弱抗氧化)雙重途徑放大PDT療效。
體外ROS生成提升130%,體內腫瘤完全抑制率達80%。
靶向遞送系統:
腫瘤細胞膜包裹增強同源靶向,腫瘤富集效率提高1.5倍(近紅外成像)。
臨床轉化潛力:
血液生化及器官病理顯示無顯著毒性(圖6),具備良好生物安全性。