熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
A biodegradable, flexible photonic patch for in vivo phototherapy
一種用于體內光療的可生物降解、柔性光子貼片
期刊:Nature Communications (2023年5月27日在線發表,DOI: 10.1038/s41467-023-38554-x)
摘要核心內容
本研究開發了一種名為 iCarP 的可生物降解柔性光子貼片,通過創新性地在錐形光纖(TOF)與聚酯貼片(PMCL)間構建微米級空氣間隙,實現了非侵入性、大面積、深穿透的光照調控。iCarP 結合了光纖的衍射、空氣間隙的雙重折射及貼片內反射,形成“燈泡式”照明模式,可將光高效導向目標組織。實驗證明,iCarP 支持廣譜、高強度、連續/脈沖式光照,穿透深度達1.5 cm,適用于不同光敏劑的光療(如光熱治療、光合作用治療)。其兼容微創胸腔鏡手術植入,在跳動的心臟上穩定工作,為內臟器官的光學診療提供了安全、精準的平臺。
研究目的
解決現有體內光照技術難以兼顧 大面積、深穿透、非侵入性 的難題;開發一種可生物降解、柔性適配器官表面的光子器件,支持多種光療應用(如腫瘤治療、心肌梗死修復)。
研究思路
器件設計:
核心結構:錐形光纖(TOF)嵌入可生物降解透明聚酯(PMCL)貼片,TOF與PMCL間預留可控微米級空氣間隙(圖1a)。
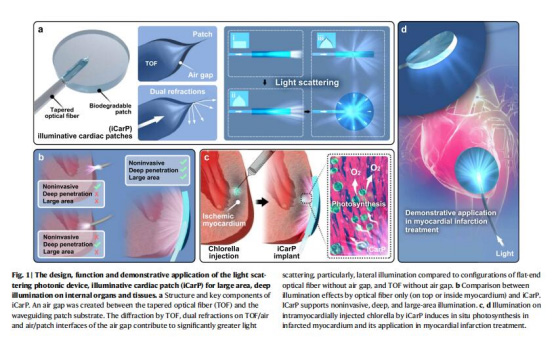
性能驗證:
離體實驗:模擬光照分布(圖2e)、葉綠素光合產氧(圖2h)、離體心臟光照穿透(圖4d)。
在體應用:小鼠腫瘤光熱治療(圖4j,k)、大鼠心肌梗死光合治療(圖5c-f)、犬類微創植入(圖6b-d)。
機制拓展:
通過調控空氣間隙距離(d=5–25 μm)優化散射效率(圖2f)。
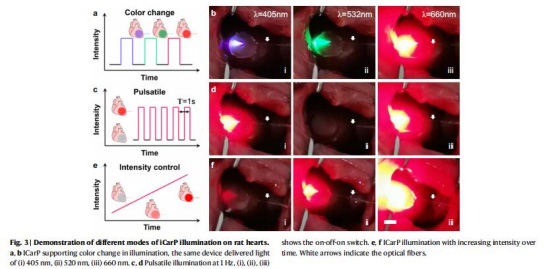
驗證多波長(405–808 nm)、脈沖/連續光照模式的兼容性(圖3a-d)。
測量數據及其意義
(1)光散射性能(圖2)
數據:
模擬顯示iCarP散射角達130°(圖2e),比平面光纖(20°)提升6.5倍。
離體實驗:iCarP光照覆蓋直徑3 cm區域(圖4d),而傳統光纖僅覆蓋1.5 cm(圖4f)。
意義:空氣間隙設計是擴大光照范圍的關鍵,為深層組織均勻照明提供基礎。
(2)丹麥Unisense微電極數據(圖2h)
數據:
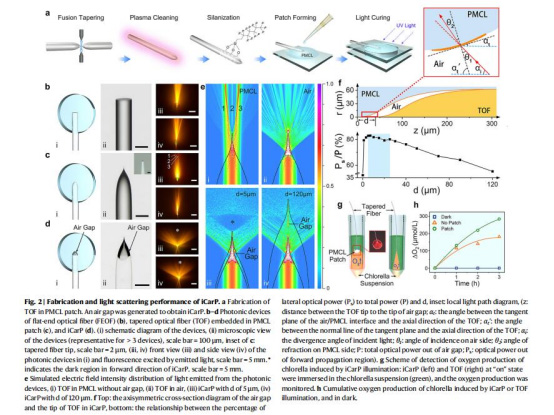
iCarP光照下葉綠素懸浮液3小時累計產氧量達284.2 μmol/L,比錐形光纖(TOF)單獨光照高25%(圖2h)。
研究意義:
直接驗證生物效應:Unisense微電極通過電化學傳感實時監測溶解氧濃度,證明iCarP的光散射顯著提升光合作用效率。
技術優勢:高靈敏度(nmol/L級檢測)、動態記錄光照生物響應,彌補了傳統光學檢測的間接性。
應用價值:為光驅動療法(如心肌梗死中的光合產氧)提供量化依據,證實iCarP的臨床轉化潛力。
(3)腫瘤光熱治療(圖4j,k)
數據:
iCarP光照5分鐘,腫瘤中心溫度達56°C,2 mm直徑區域>45°C(圖4k);傳統光纖僅49°C,1 mm區域>45°C。
H&E染色顯示iCarP組腫瘤壞死區域更大(圖4l)。

意義:iCarP的大面積均勻光照提升熱療效率,為實體瘤治療提供優化方案。
(4)心肌梗死治療(圖5c-f)
數據:
iCarP光照組(iCarP+/Light+)心肌細胞凋亡率最低(圖5d),心功能(LVEF)顯著改善(圖5f)。

纖維化面積減少20%(圖5e)。
意義:結合葉綠素的光合產氧,iCarP為缺血心肌提供局部氧供,促進組織修復。
(5)微創植入兼容性(圖6)
數據:iCarP可通過1.2 cm套管針植入犬心臟(圖6a),光照穩定(圖6d)。
意義:證實iCarP適用于臨床微創手術,拓展其在腔鏡手術中的應用場景。
結論
器件創新:iCarP通過 空氣間隙+錐形光纖+可降解貼片 三重設計,實現非侵入性、大面積(直徑3 cm)、深穿透(1.5 cm)光照。
性能優勢:
支持405–808 nm廣譜光及脈沖/連續模式(圖3)。
光照穩定性高(耐受>10萬次心臟搏動)。
應用價值:
腫瘤光熱治療:提升溫度均勻性及壞死區域(圖4)。
心肌修復:光合作用提升局部氧合,減少纖維化(圖5)。
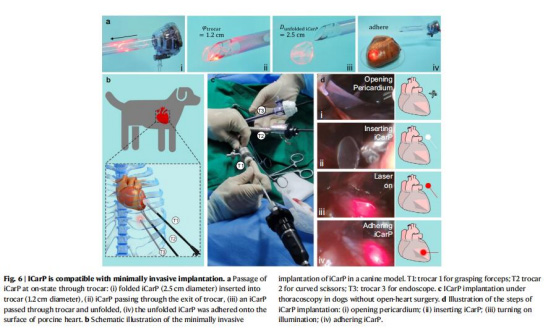
微創兼容:胸腔鏡植入成功(圖6),為臨床轉化鋪路。
生物安全性:PMCL材料可降解,移除光纖后無殘留。
研究意義與展望
iCarP 為內臟器官的光學診療提供了 柔性、可降解、微創兼容 的新工具,尤其適用于動態器官(如心臟)及深部組織的光療。未來可拓展至光遺傳學、光控藥物釋放等場景。需進一步研究長期生物相容性及連續光照的安全性。