熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Carbonic anhydrases reduce the acidity of the tumor microenvironment, promote immune infiltration, decelerate tumor growth, and improve survival in ErbB2/HER2-enriched breast cancer
碳酸酐酶可降低腫瘤微環境的酸度,促進免疫浸潤,減緩腫瘤生長,并提高富含 ErbB2 HER2 的乳腺癌的生存率
期刊:Breast Cancer Research
DOI:10.1186/s13058-023-01644-1
摘要核心內容
本研究通過多維度方法(生物信息學分析、離體器官實驗、體內小鼠模型)揭示:
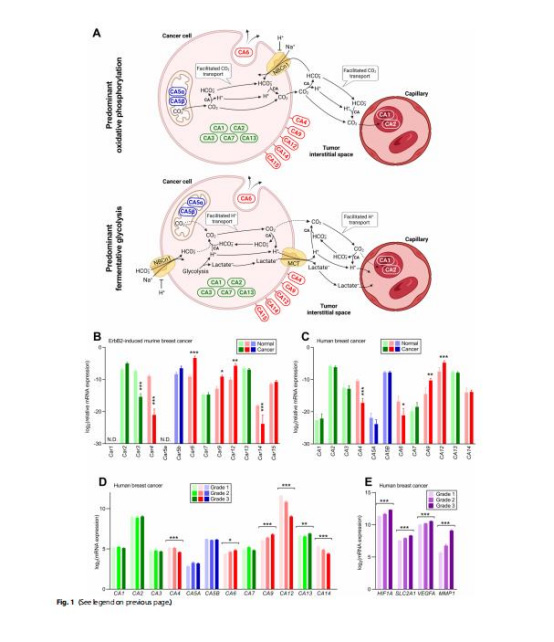
碳酸酐酶(CAs)——尤其是胞外異構體(CA4/6/9/12/14)——在乳腺癌中動態表達,通過催化CO?/HCO??緩沖反應降低腫瘤微環境酸度。
CA表達與預后相關性相反:在基底樣/三陰性乳腺癌中高表達預示不良預后,而在HER2富集型乳腺癌中卻顯著改善生存率(風險比HR=0.581)。
CA抑制劑乙酰唑胺(ATZ) 加劇腫瘤酸化(pH降至6.8),減少免疫細胞浸潤(CD3?T細胞、CD19?B細胞、F4/80?巨噬細胞降低50%),抑制炎癥因子(IL1a/IL1b/IL6、NFκB1),并加速ErbB2誘導的小鼠乳腺癌生長(體積增長20倍 vs 對照10倍)。
機制核心:CAs通過促進H?從癌細胞和間質中清除,提升pH,增強HER2陽性腫瘤的免疫浸潤與抗腫瘤炎癥反應。
關鍵詞:乙酰唑胺、酸中毒、乳腺癌、碳酸酐酶、ErbB2/HER2、腫瘤免疫、代謝、灌注、腫瘤微環境
研究目的
闡明CAs(特別是胞外異構體)在乳腺癌亞型中的表達模式及預后意義。
探究CAs調控腫瘤微環境pH的分子機制(酸排泄、H?擴散動力學)。
驗證CA抑制劑ATZ對腫瘤免疫微環境、代謝與生長的影響。
解析HER2富集型乳腺癌中CA表達與免疫浸潤的臨床相關性。
研究思路
生物信息學分析:
整合人類蛋白質組數據庫(Proteomic Data Commons)、單細胞轉錄組(Broad Institute)和臨床預后數據(Kaplan-Meier Plotter),分析CA異構體在乳腺癌亞型中的表達及生存相關性。
離體器官實驗:
從人/鼠乳腺癌組織分離原代器官團,使用熒光探針(BCECF、carboxy-SNARF-1、Fluorescein DHPE)實時監測胞內/胞外pH動態。
應用CA抑制劑(乙酰唑胺、AMB、FC5-207A)評估CA活性對酸排泄的貢獻。
體內小鼠模型:
ErbB2轉基因小鼠乳腺癌模型(自發成瘤)。
干預組:每日腹腔注射ATZ(40 mg/kg);對照組:溶劑(25% DMSO)。
監測腫瘤生長(游標卡尺測量)、免疫組化(CD3/CD19/F4/80/Ki67/CD105)、微透析代謝分析(乳酸/葡萄糖)。
關鍵技術創新:
Unisense pH500微電極活體監測腫瘤pH梯度(圖8A)。
測量數據與研究意義
CA表達與預后
數據:
HER2富集型乳腺癌中,胞外CAs高表達顯著改善生存(HR=0.581, P<0.001)(圖3C)。
基底樣乳腺癌中CA9/CA13高表達預示不良預后(HR=1.313–1.502)(圖5I,K)。
意義:首次揭示CA在HER2陽性乳腺癌中的保護性作用,挑戰傳統“CA促癌”認知。
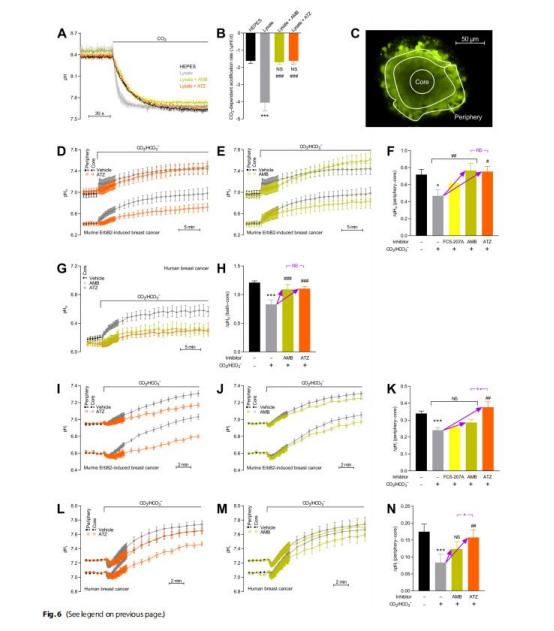
pH動力學(圖6-7)
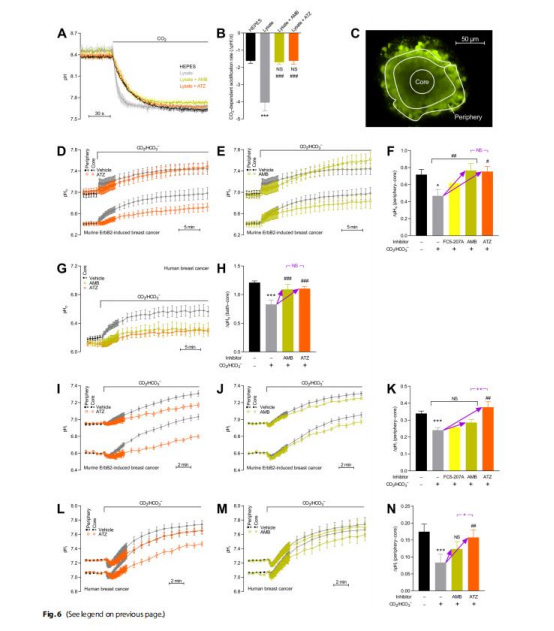
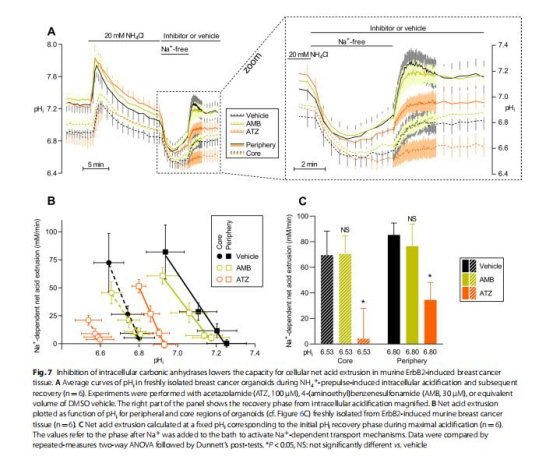
數據:
胞外CAs通過加速CO?/HCO??緩沖反應,減少器官團核心-外周pH梯度(圖6F,H)。
ATZ抑制胞內CA后,癌細胞凈酸排泄能力下降(圖7B,C)。
意義:CAs通過提升H?有效遷移率,緩解腫瘤酸中毒。
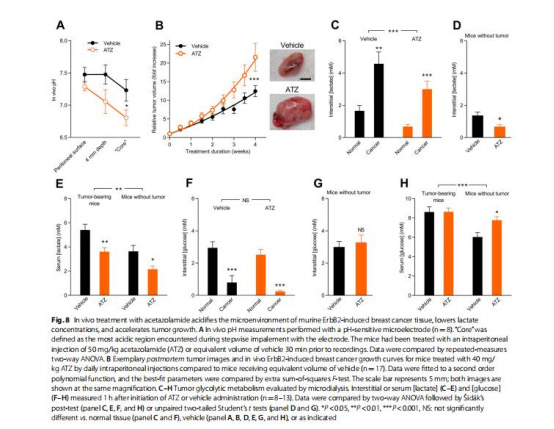
活體腫瘤pH(圖8A)
數據:
ATZ處理組腫瘤核心pH降至6.8(對照組pH 7.2)。
意義:CA抑制顯著加劇腫瘤酸化,為后續免疫抑制提供解釋。
免疫與代謝(圖8-10)
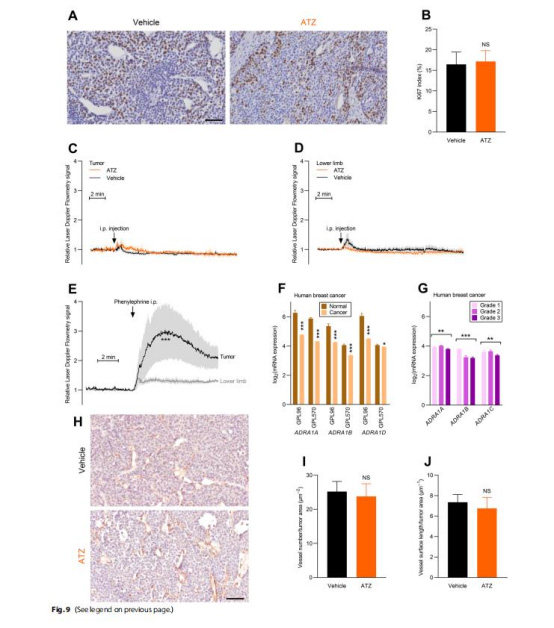
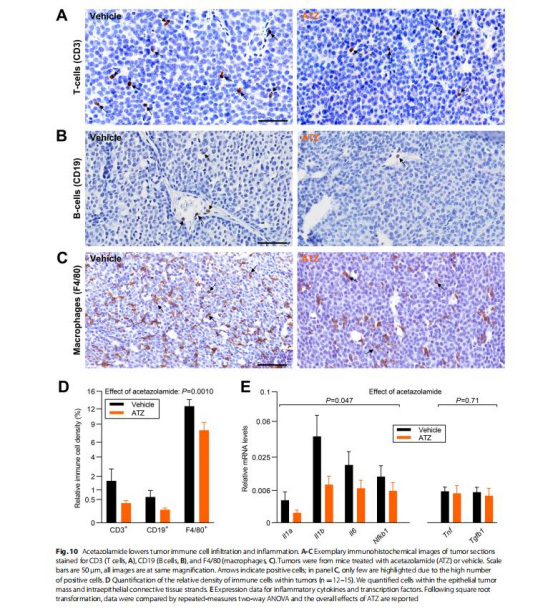
數據:
ATZ降低腫瘤內免疫細胞密度(T/B/巨噬細胞↓50%)(圖10D)、炎癥因子(IL1a/IL1b/IL6↓)(圖10E)。
ATZ降低乳酸水平(腫瘤/血清/正常組織),但不影響葡萄糖/灌注(圖8C-E, 圖9C-D)。
意義:CA活性通過調節pH影響免疫浸潤與代謝重編程。
腫瘤生長(圖8B)
數據:
ATZ處理4周后腫瘤體積增長20倍(對照組10倍)。
意義:CA抑制在HER2陽性模型中加速腫瘤進展,與臨床生存數據一致。
Unisense微電極數據的深度解析
技術原理與創新性
設備組成:
pH500玻璃微電極(Unisense, Denmark):針型傳感器(直徑≈1mm),直接插入活體組織。
高靈敏度放大器:實時轉換H?濃度至電壓信號,精度達0.01 pH單位。
空間定位:以1mm步進深度記錄pH梯度(腹膜表面→腫瘤核心)。
校準方法:
使用標準緩沖液(pH 4.0/7.0/10.0)預校準,術中參比電極置于腹腔。
實驗設計:
小鼠麻醉后暴露腫瘤,微電極逐步穿刺(圖8A),同步記錄不同深度pH。
對比ATZ處理組與對照組,明確CA抑制對腫瘤內pH異質性的影響。
研究意義
揭示腫瘤pH空間異質性:
首次在活體證實HER2陽性腫瘤核心pH(7.2)高于傳統模型(如致癌劑誘導型pH 6.7),提示亞型特異性酸代謝。
ATZ使核心pH降至6.8,證明CAs是維持堿性微環境的關鍵。
關聯免疫抑制機制:
微電極數據直接關聯ATZ導致的酸化與免疫細胞浸潤減少(圖10D),為“酸中毒抑制免疫”假說提供活體證據。
技術優勢:
活體動態監測:避免離體組織pH偏移,真實反映腫瘤微環境。
高空間分辨率:1mm步進精度捕捉pH梯度,優于非侵入式成像(如PET)。
局限性
單點穿刺:僅反映穿刺路徑pH,對腫瘤異質性覆蓋不足。
麻醉影響:可能改變基礎代謝狀態,需結合清醒動物監測驗證。
結論
CA的雙重角色:
在HER2富集型乳腺癌中,胞外CAs通過提升pH增強免疫浸潤,抑制腫瘤生長,改善生存。
在基底樣乳腺癌中,CA9/CA13高表達促進惡性進展。
ATZ的悖論效應:
抑制CA加劇腫瘤酸化,減少CD3?/CD19?/F4/80?細胞浸潤,削弱抗腫瘤免疫,加速HER2陽性腫瘤生長。
臨床啟示:
HER2陽性患者慎用CA抑制劑(如青光眼治療);靶向CA異構體需考慮乳腺癌亞型特異性。
創新模型
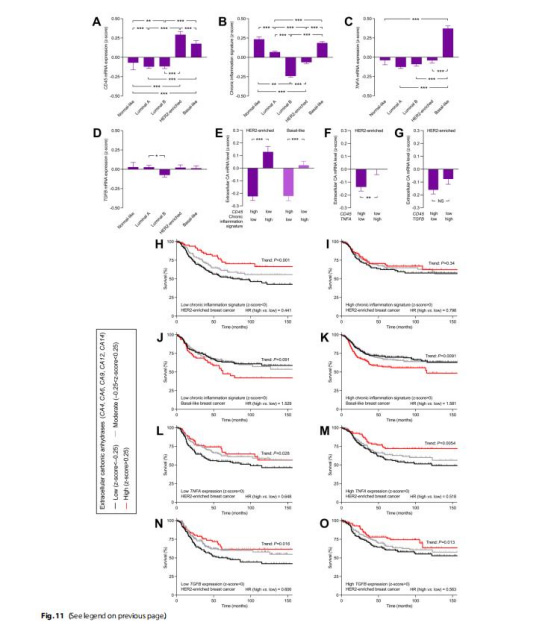
提出“CA-pH-免疫軸”調控機制(圖11):
HER2富集型:CA高表達 → pH↑ → 免疫細胞浸潤↑ → 炎癥反應↑ → 腫瘤控制↑。
基底樣型:CA9↑ → pH↓ → 免疫逃逸 → 進展加速。
---
圖示總結:
圖1:CAs催化CO?/HCO??緩沖反應促進H?清除
圖6:CA抑制加劇器官團pH梯度
圖8A:Unisense微電極活體記錄腫瘤pH
圖10:ATZ減少免疫細胞浸潤
圖11:CA生存獲益依賴腫瘤炎癥狀態