熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
A novel lonidamine derivative targeting mitochondria to eliminate cancer stem cells by blocking glutamine metabolism
一種靶向線粒體的新型氯尼達明衍生物,通過阻斷谷氨酰胺代謝來消除癌癥干細胞
期刊:Pharmacological Research(DOI: 10.1016/j.phrs.2023.106740)
摘要核心內容
本研究設計了一種新型線粒體靶向化合物HYL001(洛尼達明衍生物),通過特異性阻斷谷氨酰胺(Gln)代謝,選擇性消除癌癥干細胞(CSCs)。HYL001對乳腺癌干細胞(BCSCs)和肝癌干細胞(HCSCs)的抑制活性分別比原型藥物洛尼達明(LND)強380倍和340倍。機制上,HYL001下調谷氨酰胺酶(GLS)表達,阻斷谷氨酰胺代謝,抑制三羧酸(TCA)循環,放大線粒體氧化應激,誘導CSCs凋亡。體內實驗證實HYL001顯著抑制腫瘤生長和轉移,并與紫杉醇(PTX)協同增效。此外,HYL001有效抑制肝癌患者新鮮腫瘤組織中的CSCs。
研究目的
開發高效低毒的CSCs靶向藥物,解決CSCs介導的腫瘤復發、轉移和耐藥問題;闡明HYL001通過靶向線粒體代謝清除CSCs的分子機制。
研究思路
分子設計:
基于線粒體膜負電性,將線粒體靶向單元(TPP?)與LND通過芳香環連接(非長鏈烷烴),合成HYL001(圖1a)。
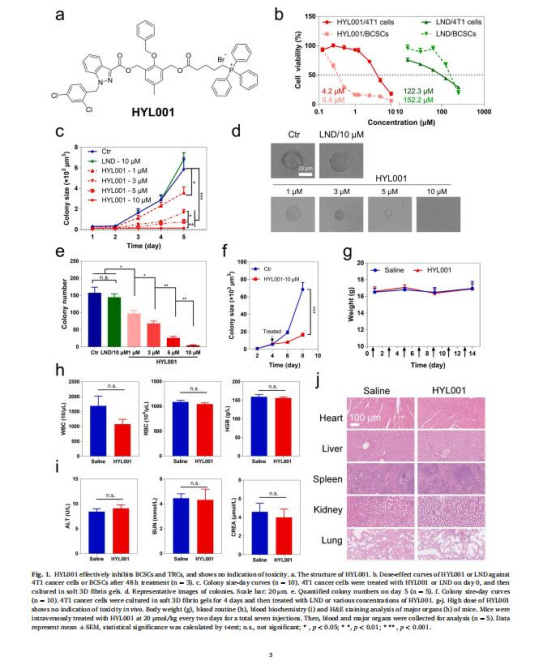
評估HYL001對CSCs(乳腺球/腫瘤再生細胞TRCs)的選擇性殺傷(圖1b-f)。
分析線粒體結構/功能(膜電位、活性氧)、代謝(TCA循環、OXPHOS)及凋亡通路(圖2-4)。
機制探索:
代謝組學揭示Gln代謝阻斷(圖3a-b);驗證GLS表達下調(圖3d-e)及CSCs的Gln依賴性(圖3f-m)。
體內評價:
皮下/原位/轉移瘤模型驗證抗腫瘤效果(圖5-6);肝癌患者新鮮組織實驗(圖7)。
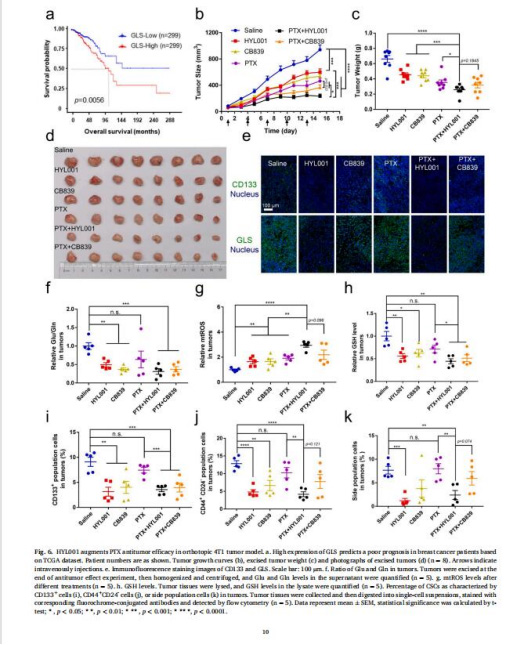
聯合治療:
與PTX聯用增強療效(圖6b-d)。
測量數據及其意義
(1)CSCs選擇性殺傷(圖1)
數據:HYL001對BCSCs的IC??(0.44 μM)比LND低380倍(圖1b);顯著抑制TRCs集落形成(圖1c-e)。
意義:HYL001高效靶向CSCs,克服LND臨床療效不足的缺陷。
(2)線粒體損傷與凋亡(圖2)
數據:
電鏡顯示HYL001破壞線粒體嵴結構(圖2a);JC-1檢測膜電位崩潰(圖2b-c)。
流式細胞術證實劑量依賴性凋亡(圖2d, g)。
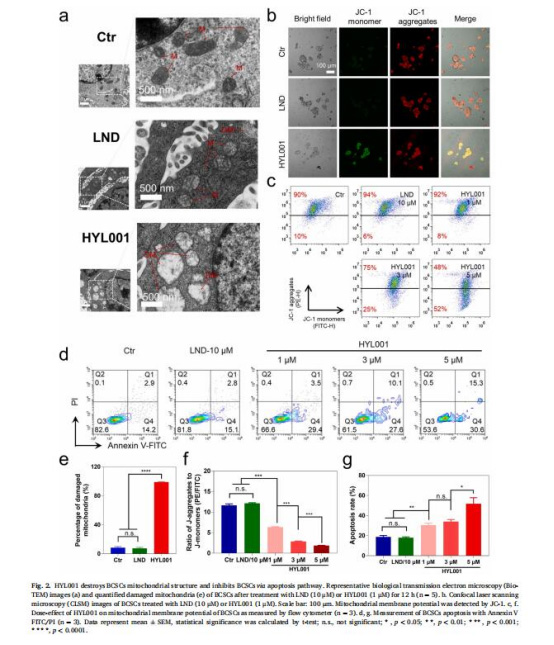
意義:HYL001通過線粒體途徑誘導CSCs凋亡。
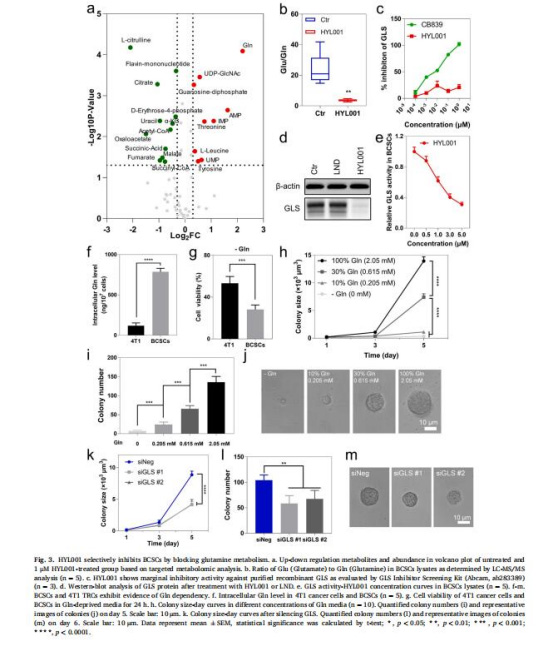
(3)Gln代謝阻斷(圖3-4)
數據:
代謝組學顯示Gln積累、Glu/Gln比值下降(圖3a-b);Western blot驗證GLS蛋白下調(圖3d)。
TCA循環中間產物(α-KG、琥珀酸等)顯著減少(圖4b);ATP水平下降(圖4e)。
意義:HYL001通過抑制GLS阻斷Gln代謝,破壞CSCs能量供應。
(4)氧化應激放大(圖4)
數據:
HYL001降低谷胱甘肽(GSH)(圖4f),增加線粒體活性氧(mtROS)(圖4g-i)。
抗氧化劑(GSH/TEMPO)可逆轉HYL001的殺傷作用(圖4j-m)。
意義:代謝紊亂引發氧化應激,是CSCs死亡的關鍵機制。
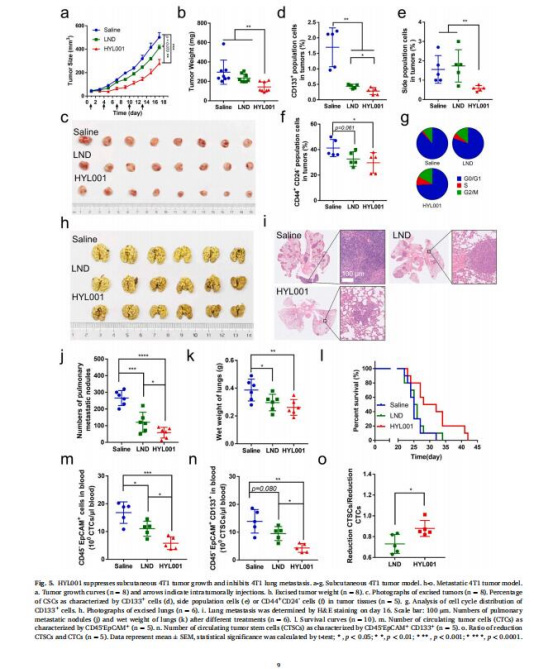
(5)體內抗腫瘤效果(圖5-6)
數據:
皮下瘤模型:HYL001抑制腫瘤生長(TIR=44%),降低CD133? CSCs比例82.1%(圖5a-f)。
轉移模型:減少肺轉移結節(300→60),延長生存期31.2%(圖5h-l)。
聯合PTX:腫瘤抑制率提升至75%(圖6b-d)。
意義:HYL001單藥或聯用均能有效清除CSCs,抑制腫瘤進展。
(6)臨床樣本驗證(圖7)
數據:HYL001處理肝癌患者新鮮組織后,CD133? CSCs減少,GLS表達下降(圖7h-i, m)。
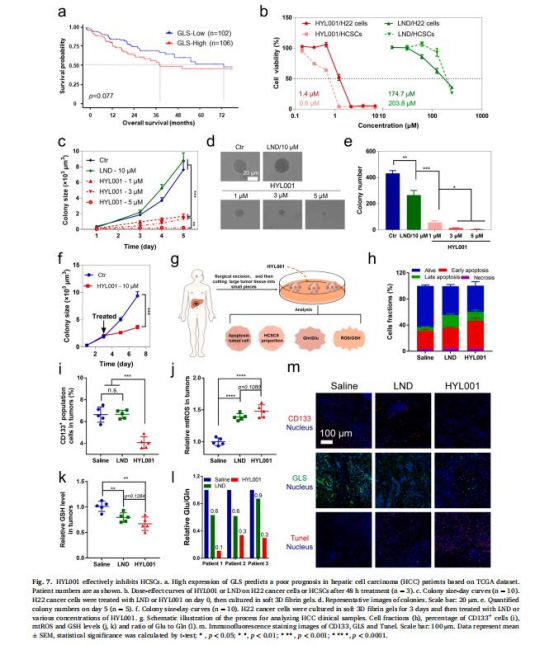
意義:HYL001在臨床樣本中保持抗CSCs活性,具轉化潛力。
丹麥Unisense微電極數據的詳細解讀
測量目的與技術原理
目的:直接量化BCSCs的線粒體氧消耗速率(OCR),評估HYL001對氧化磷酸化(OXPHOS)的抑制。
技術原理:Unisense微電極采用Clark氧電極,通過電化學傳感實時檢測溶解氧濃度變化,靈敏度高(可測nmol/L級氧消耗)。
實驗結果(圖4c-d)

數據:
HYL001處理4小時后,BCSCs的OCR呈劑量依賴性下降(5 μM HYL001使OCR降低60%)。
LND(10 μM)對OCR無顯著影響。
機制關聯:OCR下降直接證實HYL001阻斷Gln代謝后,削弱了TCA循環的電子供體(NADH/FADH?)生成,導致OXPHOS受阻。
研究意義
直接證據:提供HYL001抑制線粒體呼吸鏈功能的實時代謝數據,彌補間接指標(如ATP檢測)的局限性。
技術優勢:
高時空分辨率:可檢測少量細胞(10?細胞)的瞬時氧耗變化,適用于原代CSCs等稀缺樣本。
動態監測:揭示HYL001的快速起效特性(4小時內顯著抑制OCR)。
生物學價值:
證實CSCs依賴OXPHOS供能,靶向線粒體代謝是清除CSCs的有效策略。
為開發類似線粒體靶向藥物提供關鍵代謝表型評估方法。
結論
分子創新:HYL001通過芳香環連接TPP?與LND,實現高效線粒體靶向,毒性低于長鏈烷烴衍生物。
機制突破:
下調GLS表達→阻斷Gln代謝→抑制TCA循環/OXPHOS→放大mtROS→選擇性誘導CSCs凋亡。
CSCs因高Gln攝入和GLS表達而對該機制敏感(圖3f-g)。
治療價值:
單藥抑制腫瘤生長、轉移并清除CSCs;與PTX聯用顯著增效。
在肝癌患者組織中驗證抗CSCs活性,具臨床轉化潛力。
---
總結:本研究通過理性設計線粒體靶向藥物HYL001,揭示了Gln代謝在CSCs維持中的核心作用,為克服腫瘤耐藥提供了新策略。丹麥Unisense微電極技術為線粒體代謝研究提供了高靈敏度工具,直接證實了HYL001對OXPHOS的抑制,深化了對代謝靶向治療機制的理解。