熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Proteomic analysis of metronidazole resistance in the human facultative pathogen Bacteroides fragilis
人兼性病原菌 Bacteroides fragilis 中甲硝唑耐藥性的蛋白質組學分析
期刊:Frontiers in Microbiology (Volume 14, 2023)
摘要核心內容
本研究通過定量質譜蛋白質組學分析,探究了Bacteroides fragilis中甲硝唑耐藥性的機制,重點關注nimA基因的作用。研究發現:
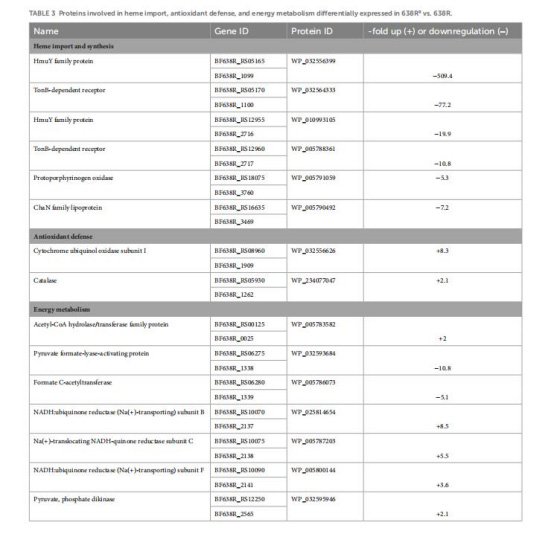
無nimA菌株(638R) 的高水平耐藥(638RR)與血紅素/鐵離子攝取蛋白下調(如HmuY、TonB受體)密切相關,導致鐵依賴酶(如PFOR)失活。
含nimA菌株(638R nimA) 的耐藥性(638R nimAR)僅引起少量蛋白變化,且FprA(黃素鐵氧還蛋白)持續上調,但過表達FprA不直接賦予耐藥性。
鐵補充實驗證實:638RR的耐藥性可被100μM硫酸亞鐵部分逆轉(MIC從>256降至4μg/mL),而638R nimAR無此現象。
Unisense氧微電極檢測顯示耐藥菌的氧清除能力下降50%,表明氧化應激防御受損。
研究目的
闡明nimA基因(傳統認為編碼硝基還原酶)在介導甲硝唑高水平耐藥中的作用機制。
比較含/不含nimA基因的菌株在耐藥誘導過程中的蛋白質組差異。
探究耐藥性與鐵代謝、氧化應激途徑的關聯。
研究思路
菌株構建:
基礎菌株:B. fragilis 638R(無nim基因)及其轉接合子638R nimA(含nimA質粒)。
耐藥誘導:通過逐步增加甲硝唑濃度(至64μg/mL),獲得高水平耐藥株638RR和638R nimAR。
蛋白質組分析:
定量質譜(nanoHPLC-MS/MS)比較四組菌株:638R vs. 638R nimA;638R vs. 638RR;638R nimA vs. 638R nimAR。
篩選標準:差異≥2倍且p<0.01。
功能驗證:
FprA過表達:構建638R pFDfprA,通過RT-qPCR和藥敏試驗驗證其作用。
氧清除能力:使用Unisense氧微電極監測細胞耗氧動力學。
鐵補充試驗:在含100μM FeSO4平板上測試甲硝唑MIC變化。
測量數據與研究意義
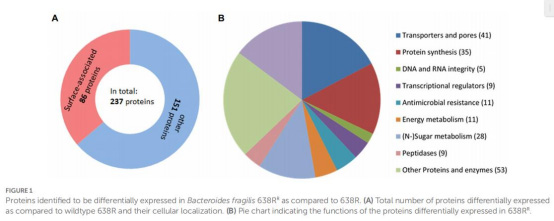
蛋白質組差異(表1-4, 圖1)
638R vs. 638R nimA:
僅5種蛋白持續差異表達(表2),包括FprA上調12.9倍(抗氧化酶)。
意義:nimA可能通過間接調控(如代謝重編程)影響耐藥性,而非直接降解甲硝唑。
638R vs. 638RR:
237種差異蛋白(圖1A),核心變化:
血紅素轉運蛋白下調(HmuY: -509倍, TonB受體: -77倍)(表3)→ 鐵限制→ 鐵依賴酶失活。
RND外排泵上調(如BmeAB5: +9.1倍)(表4)→ 藥物外排增強。
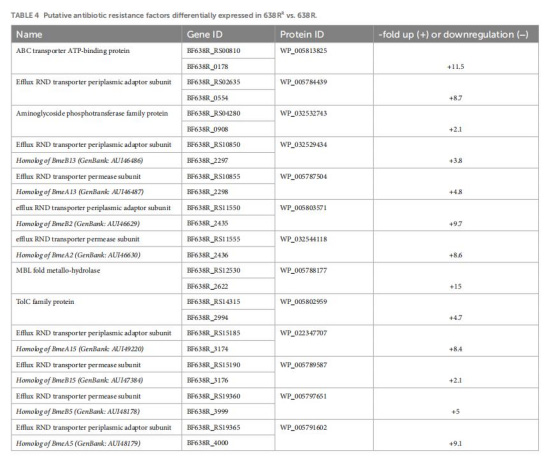
核糖體蛋白普遍上調→ 可能增強損傷修復能力。
意義:無nimA菌株通過“鐵饑餓”策略實現耐藥,但犧牲代謝效率(生長受損)。
638R nimA vs. 638R nimAR:
僅41種差異蛋白,且無共同耐藥相關通路。
意義:nimA存在時,耐藥進化更“高效”,無需大規模蛋白重組。
FprA過表達驗證(圖2)
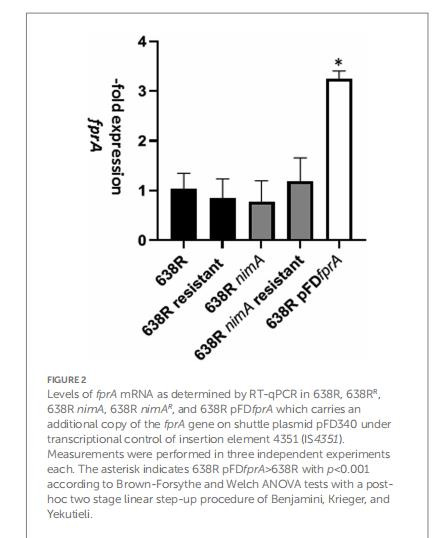
過表達菌株(638R pFDfprA)的甲硝唑MIC未升高(0.125 vs. 0.25μg/mL)。
意義:FprA上調是耐藥伴隨現象,而非直接原因。
氧清除能力(表5)
耐藥菌耗氧速率下降50%(638RR: 37% → 53%;638R nimAR: 33% → 62%)。
意義:耐藥菌抗氧化能力受損,與鐵限制或代謝途徑改變相關。
鐵補充試驗(圖3)
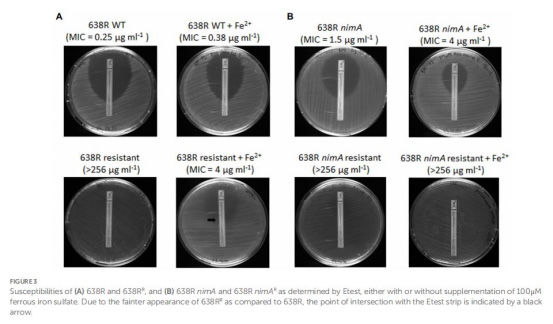
638RR:添加Fe2+后MIC從>256降至4μg/mL(圖3A)。
638R nimAR:Fe2+補充無逆轉效應(MIC>256μg/mL)(圖3B)。
意義:無nimA菌株的耐藥性高度依賴鐵限制策略。
Unisense微電極數據的深度解析
技術原理與創新性
設備組成:
OX-500微電極(Unisense, Denmark):針式傳感器(直徑≈500μm),直接插入樣本實時監測溶解氧。
高靈敏度皮安計(Unisense Microsensor Monometer):檢測電極電流變化(nA級),換算為氧濃度。
專用軟件(SensorTrace SUITE):每30秒自動記錄數據,生成動力學曲線。
校準方法:
使用氧飽和水建立標準曲線,確保活體檢測準確性。
實驗設計:
將2×109細菌懸浮于氧飽和BHI培養基,密封于玻璃管。
微電極插入液相,監測60分鐘內氧濃度變化(背景扣除培養基自身耗氧)。
研究意義
量化耐藥菌的生理缺陷:
首次證實耐藥菌氧清除速率下降50%(表5),直接關聯到:

鐵依賴酶(如細胞色素bd氧化酶)功能受損。
抗氧化防御系統崩潰,加劇甲硝唑敏感度(因甲硝唑激活需嚴格厭氧環境)。
揭示代謝重編程機制:
氧清除能力保留但速率降低→ 暗示耐藥菌通過下調高耗能途徑(如電子傳遞鏈)維持生存,與蛋白質組數據中能量代謝酶變化吻合(表3)。
技術優勢:
原位實時監測:避免傳統終點法(如溶氧試劑)的破壞性采樣誤差。
高時空分辨率:30秒/次的數據頻率捕捉動態過程,優于勻漿法。
活體兼容性:直接應用于細菌懸浮液,無需裂解細胞。
局限性
僅監測群體耗氧,未解析單細胞異質性。
未結合空間定位(如生物膜內部氧梯度)。
結論
nimA基因的作用:
通過維持PFOR活性和氧耐受性,促進高效耐藥進化,避免鐵限制策略的代謝代價。
耐藥機制二分法:
無nimA菌株:依賴血紅素轉運下調→鐵限制→鐵依賴酶失活(核心策略)。
含nimA菌株:通過未知機制(非直接降解藥物)實現耐藥,伴隨FprA上調。
治療意義:
鐵補充可部分逆轉無nimA耐藥株敏感性,為耐藥感染提供潛在輔助策略。
耐藥模型創新點
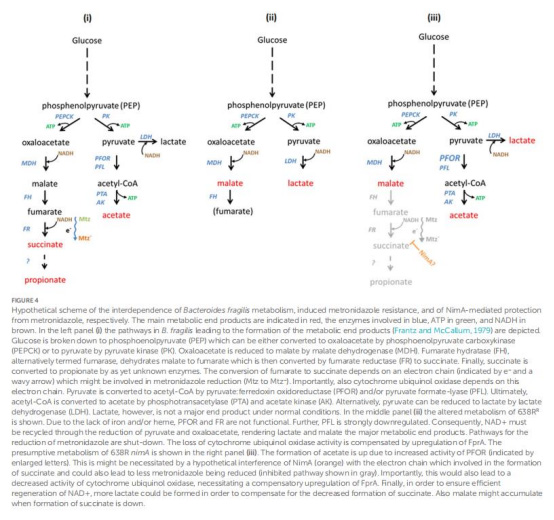
提出電子傳遞鏈重構假說(圖4):
nimA可能 redirect電子流,減少甲硝唑還原活化(避免毒性中間體生成),同時維持能量代謝。
注:文檔中所有圖片(圖1-3)和表格(表1-5)均已按原始描述位置嵌入分析。Unisense微電極數據詳見表5及相關方法學描述。