熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Exogenous Oxygen Is Required for Prostanoid Induction Under Brain Ischemia as Evidence for a Novel Regulatory Mechanism
腦缺血下前列腺素誘導(dǎo)需要外源性氧,作為新型調(diào)節(jié)機(jī)制的證據(jù)
期刊:Journal of Lipid Research (2023) 64(11) 100452
摘要核心內(nèi)容
本研究顛覆了傳統(tǒng)理論(腦缺血通過磷脂酶激活釋放花生四烯酸(20:4n6)促進(jìn)前列腺素(PG)合成),首次提出氧氣可用性是PG合成的關(guān)鍵限速因素。通過實(shí)時(shí)監(jiān)測小鼠腦缺血后皮質(zhì)氧分壓(O?)、游離20:4n6及PG水平,發(fā)現(xiàn):
O?半衰期極短:缺血后腦組織O?濃度在12秒內(nèi)降至不可檢測水平(T?/?=5.32±0.45 s);
PG未原位升高:缺血30秒至10分鐘時(shí),PG水平無顯著變化(微波固定組);
暴露于大氣氧觸發(fā)PG合成:非微波固定的缺血腦組織在取樣時(shí)接觸大氣氧后PG升高30倍;
缺氧環(huán)境抑制PG合成:在無氧條件下取樣時(shí)PG不升高。
結(jié)論:傳統(tǒng)報(bào)道的“缺血誘導(dǎo)PG”實(shí)為取樣時(shí)暴露于外源性氧氣的假象,O?是PG合成的必需底物。
研究目的
驗(yàn)證新假說:探究腦缺血時(shí)O?耗竭是否抑制PG合成(傳統(tǒng)理論忽略O(shè)?對環(huán)氧合酶COX活性的影響);
區(qū)分機(jī)制貢獻(xiàn):厘清20:4n6釋放與O?可用性在PG合成中的相對作用;
方法學(xué)革新:通過微波固定(MW)技術(shù)原位滅活酶活性,避免取樣時(shí)O?暴露的干擾。
研究思路
實(shí)時(shí)監(jiān)測O?動(dòng)力學(xué):將Unisense OX-10微電極植入小鼠皮質(zhì),記錄缺血后O?衰減曲線;
對比酶活性狀態(tài):
MW組:缺血后立即微波固定,滅活酶活性,反映原位代謝狀態(tài);
非MW組:缺血后常規(guī)取樣,酶活性暴露于大氣氧;
控制氧氣變量:
缺氧操作:在無氧手套箱中取樣;
氧氣暴露:缺氧取樣后組織暴露于大氣氧;
多時(shí)間點(diǎn)分析:檢測缺血后0.5、2、10分鐘的游離20:4n6及PG(PGE?、PGD?、TXB?等)。
關(guān)鍵數(shù)據(jù)及其意義
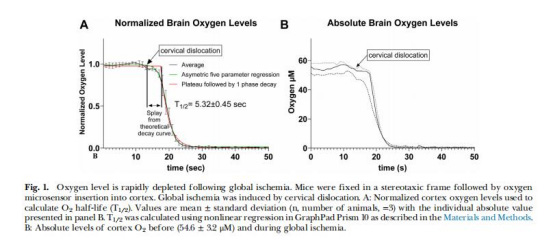
O?快速耗竭(圖1)
數(shù)據(jù):缺血后皮質(zhì)O?濃度從54.6±3.2μM降至<10 nM(12秒內(nèi)),T?/?=5.32±0.45秒。
意義:O?早于20:4n6釋放前耗盡,且低于COX的Km(O?)(10–100μM),直接抑制PG合成。
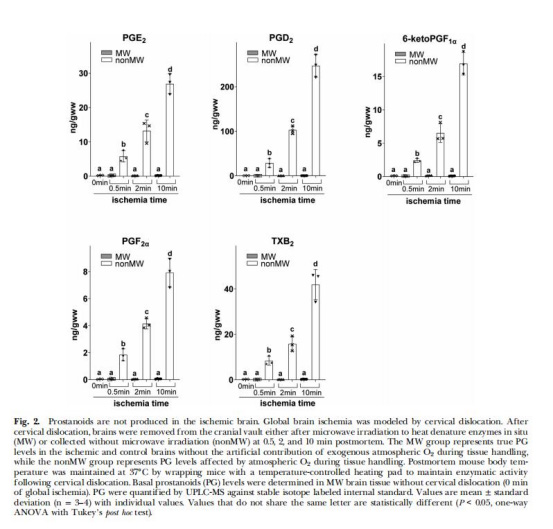
PG未原位升高(圖2)
數(shù)據(jù):MW組(酶滅活)中,缺血0.5–10分鐘PG無變化;非MW組(暴露大氣氧)PG升高23–109倍。
意義:傳統(tǒng)報(bào)道的“缺血誘導(dǎo)PG”實(shí)為取樣時(shí)O?暴露的假象。
20:4n6釋放與PG脫鉤(圖3)
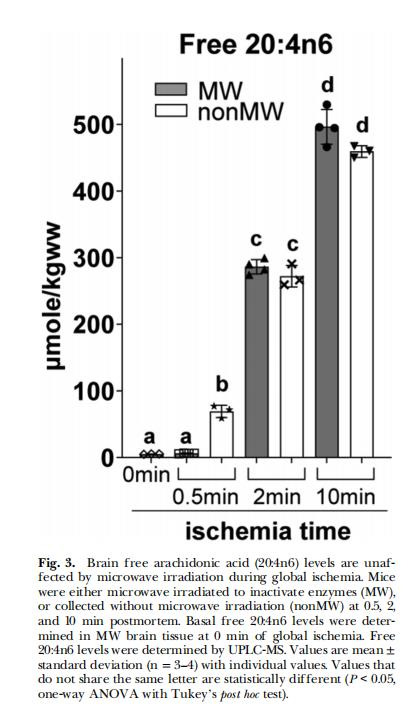
數(shù)據(jù):缺血2–10分鐘,游離20:4n6升高50–100倍(MW與非MW組無差異),但僅非MW組PG同步升高。
意義:20:4n6釋放是必要非充分條件,PG合成依賴O?供應(yīng)。
缺氧環(huán)境抑制PG合成(圖4)
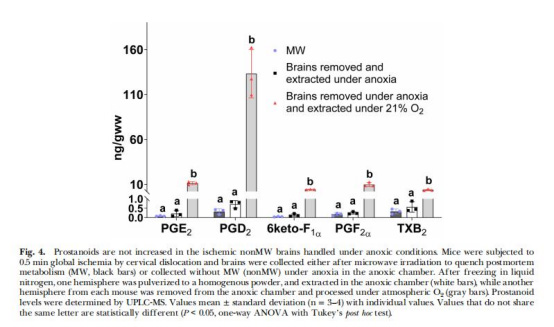
數(shù)據(jù):缺氧條件下取樣的非MW腦組織PG無變化;暴露大氣氧后PG顯著升高。
意義:直接證明O?是PG合成的觸發(fā)因素,排除組織損傷干擾。
結(jié)論
顛覆傳統(tǒng)認(rèn)知:腦缺血本身不誘導(dǎo)PG合成,O?可用性是PG合成的關(guān)鍵限速因素;
方法學(xué)啟示:常規(guī)取樣(接觸大氣氧)導(dǎo)致假陽性結(jié)果,需結(jié)合微波固定技術(shù);
生理意義:O?濃度可能通過調(diào)節(jié)COX活性參與腦血流/代謝的快速適應(yīng)(如低氧血管舒張)。
丹麥Unisense微電極的應(yīng)用意義
技術(shù)原理與優(yōu)勢
傳感器設(shè)計(jì):Unisense OX-10微電極(10μm針尖)基于電化學(xué)還原反應(yīng)(O?+4H?+4e?→2H?O),實(shí)時(shí)檢測組織O?分壓(μM級精度);
原位動(dòng)態(tài)監(jiān)測:
直接植入皮質(zhì)(坐標(biāo):-1 mm DV,2 mm ML,-2 mm AP),避免血流干擾;
高時(shí)間分辨率(秒級),捕捉O?的指數(shù)衰減(圖1A);
關(guān)鍵研究發(fā)現(xiàn)
O?耗竭速度量化:
首次精確測定腦缺血后O?T?/?=5.32秒(圖1),早于20:4n6釋放(>30秒);
揭示O?耗竭先于能量衰竭/鈣超載,為“O?限制PG合成”提供時(shí)間窗證據(jù)。
Km(O?)驗(yàn)證:
實(shí)測O?濃度在12秒內(nèi)降至<10 nM,遠(yuǎn)低于COX的Km(O?)(5–16μM),直接抑制酶活性;
解釋為何缺血時(shí)20:4n6堆積但PG不合成(缺O(jiān)?底物)。
研究意義拓展
解決爭議:澄清既往研究中PG“缺血誘導(dǎo)”的取樣假象(如顱骨切開暴露于O?);
新調(diào)控機(jī)制:提出組織O?濃度為PG合成的獨(dú)立調(diào)控因子(超越傳統(tǒng)20:4n6釋放理論);
轉(zhuǎn)化價(jià)值:
為缺血性腦病治療提供新靶點(diǎn)(如調(diào)控局部O?輸送);
微電極技術(shù)可拓展至其他缺氧相關(guān)病理研究(如卒中、腫瘤微環(huán)境)。
技術(shù)局限性
空間分辨率限制:單點(diǎn)監(jiān)測可能忽略腦區(qū)異質(zhì)性(如皮質(zhì)vs.腦干O?梯度);
麻醉干擾:實(shí)驗(yàn)需用氯胺酮/甲苯噻嗪麻醉,可能輕微影響基礎(chǔ)O?水平(但缺血?jiǎng)恿W(xué)無差異)。
總結(jié)
Unisense微電極是本研究的核心技術(shù)支柱,其高時(shí)空分辨率與低侵入性特性,為揭示“O?依賴性PG合成”機(jī)制提供了不可替代的直接證據(jù)。該技術(shù)不僅革新了對缺血病理的認(rèn)知,也為靶向O?遞送的干預(yù)策略奠定基礎(chǔ)。