熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Cervical spinal hemisection effects on spinal tissue oxygenation and long-term facilitation of phrenic,renal and splanchnic sympathetic nerve activity
頸椎半切對脊柱組織氧合以及膈、腎和內臟交感神經活動的長期促進作用的影響
期刊:Experimental Neurology 368 (2023) 114478
摘要核心內容
本研究探討中度急性間歇性缺氧(mAIH)對大鼠頸髓半切(C2Hx)后脊髓組織氧合及神經可塑性(膈神經長時程易化,pLTF;交感神經長時程易化,sympLTF)的影響。關鍵發現包括:
脊髓組織缺氧:C2Hx后2周,損傷同側膈肌運動核區脊髓組織氧分壓(PtO?)顯著降低,且與低血壓相關。
膈神經可塑性受損:完全性C2Hx損傷同側pLTF消失,但對側pLTF保留。
交感神經可塑性差異:完全性C2Hx后,內臟交感神經(splanchnic)sympLTF消失,但腎交感神經(renal)sympLTF保留。
結論:C2Hx通過低血壓加劇脊髓缺氧,損傷同側呼吸和交感神經可塑性,但保留對側呼吸及腎交感神經的可塑性,為mAIH治療脊髓損傷提供新見解。
研究目的
明確C2Hx后脊髓組織氧合狀態的變化及其機制。
評估損傷嚴重性(部分性vs.完全性C2Hx)對mAIH誘導的pLTF(同側/對側)和sympLTF的影響。
探究血壓與脊髓氧合的關系,為mAIH治療脊髓損傷的優化提供依據。
研究思路
動物模型:雄性SD大鼠分為三組:
假手術組(Intact)
部分性C2Hx(單一切割)
完全性C2Hx(切割+1mm組織抽吸)
時間點:損傷后2周進行終末神經生理學實驗。
干預:給予mAIH(3次5分鐘13.5%O?,間隔5分鐘)。
檢測指標:
脊髓PtO?:丹麥Unisense 50μm氧微電極植入C4節段膈肌運動核(圖1B)。
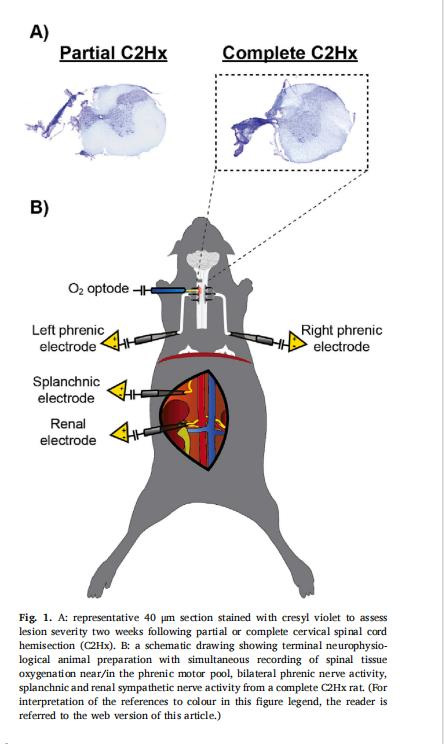
神經活動:雙側膈神經、內臟/腎交感神經放電(圖1B)。
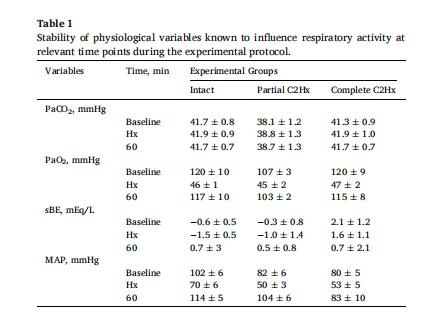
生理參數:動脈血壓、血氣分析(表1)。
測量數據及其意義
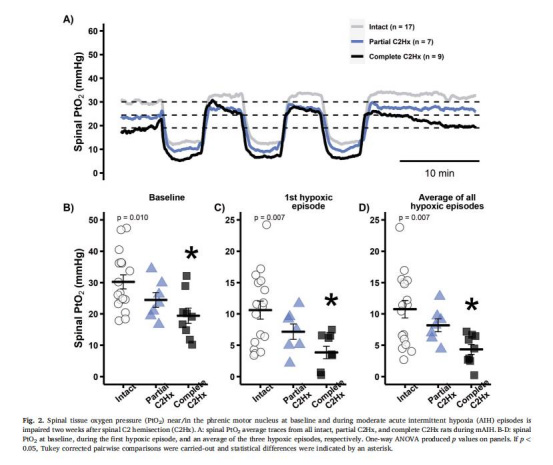
脊髓組織氧分壓(PtO?)
數據來源:圖2
結果:
完全性C2Hx組基線PtO?顯著低于假手術組(圖2B)。
mAIH期間PtO?進一步降低(圖2C-D)。
意義:證實C2Hx通過低血壓減少脊髓氧供,加劇組織缺氧,可能通過腺苷積累抑制神經可塑性。
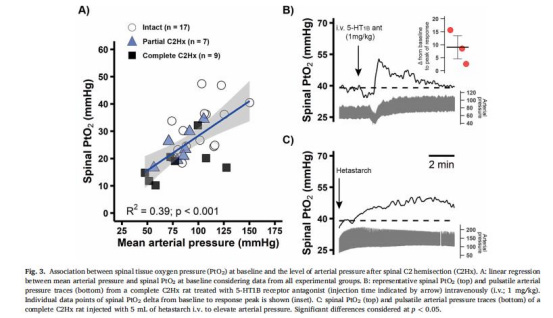
血壓與PtO?相關性
數據來源:圖3
結果:線性回歸顯示平均動脈壓(MAP)與PtO?正相關(R2=0.39,p<0.01)。
意義:低血壓是C2Hx后脊髓缺氧的關鍵機制;擴容(如羥乙基淀粉)可恢復PtO?(圖3C)。
膈神經長時程易化(pLTF)
數據來源:圖4(同側)、圖5(對側)
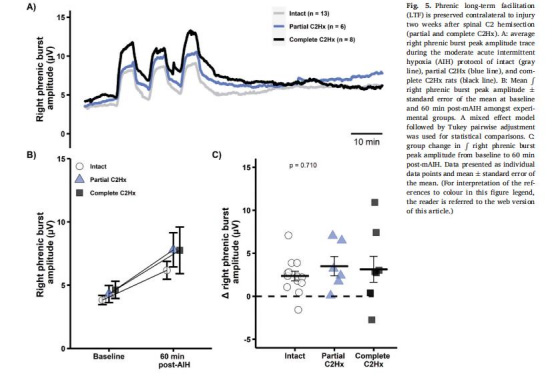
結果:
完全性C2Hx組同側pLTF消失(圖4B-C)。
對側pLTF保留(圖5B-C)。
意義:損傷側pLTF受損與脊髓缺氧及5-HT能神經支配丟失相關,對側保留提示mAIH治療潛力。
交感神經長時程易化(sympLTF)
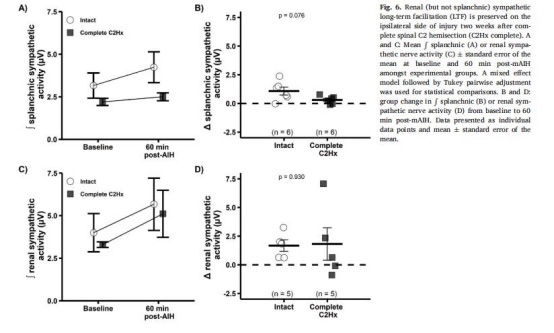
數據來源:圖6
結果:
腎交感神經sympLTF在完全性C2Hx后保留(圖6C-D)。
內臟交感神經sympLTF消失(圖6A-B)。
意義:腎交感神經可塑性可能通過升高血壓改善脊髓氧合,抵消SCI后低血壓。
脊髓缺氧機制:C2Hx后低血壓(而非毛細血管周細胞收縮)是脊髓PtO?降低的主因(圖3)。
可塑性差異:
同側pLTF和內臟sympLTF受損,但對側pLTF和腎sympLTF保留。
保留的交感可塑性可能通過血壓升高改善脊髓氧合。
治療意義:mAIH可能通過保留的交感神經可塑性(如腎神經)改善SCI后低血壓,間接支持呼吸功能恢復。
丹麥Unisense微電極測量數據的詳細解讀
技術背景與操作流程
微電極型號:Unisense針型氫微傳感器(50μm直徑),專為組織氧分壓(PtO?)監測設計。
植入位點:C4脊髓節段(膈肌運動核區),坐標:中線旁1.5mm,背側1.5mm(圖1B)。
校準方法:雙點校準(21%O?生理鹽水vs.無氧溶液),確保數據精確性。
采樣頻率:1Hz,數據平滑處理(10秒平均)。
研究意義
揭示脊髓缺氧機制:
首次證實C2Hx后同側膈肌運動核區PtO?顯著降低(圖2),且與損傷嚴重性正相關。
通過線性回歸(圖3A)明確血壓是PtO?主要調控因素(R2=0.39),為治療提供靶點。
闡明mAIH效應機制:
mAIH期間PtO?進一步降低(圖2C-D),提示缺氧加劇可能導致腺苷積累,抑制5-HT依賴性可塑性(如pLTF)。
擴容(羥乙基淀粉)或升壓藥(5-HT1B拮抗劑)可恢復PtO?(圖3B-C),驗證血壓的核心作用。
技術優勢:
高時空分辨率:50μm微電極實現細胞水平氧監測,優于傳統方法(如激光多普勒)。
動態監測能力:實時記錄mAIH期間PtO?變化(圖2A),揭示缺氧程度與神經可塑性的負相關。
跨模型適用性:在麻醉、肌松條件下仍穩定工作,支持復雜神經生理實驗。
對SCI研究的價值
解決爭議:明確C2Hx急性期(2周)脊髓氧合狀態,解釋既往pLTF結果不一致性(如慢性期恢復)。
指導治療:證實血壓管理(如擴容)可改善脊髓氧合,為優化mAIH療法提供依據。
轉化潛力:Unisense微電極可作為評估神經保護策略(如藥物、氧療)的有效工具。
---
總結:Unisense微電極是揭示SCI后脊髓缺氧機制的關鍵技術,其高精度動態監測能力為理解神經可塑性障礙及優化治療策略提供不可替代的支持。