熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Antitumor effects of Endostar (rh-endostatin) combined with gemcitabine in different administration sequences to treat Lewis lung carcinoma
恩度(rh-內皮抑素)聯合吉西他濱不同給藥順序治療Lewis肺癌的抗腫瘤作用
期刊:Cancer Management and Research, , 3469-3479
發表年份:2019
摘要內容
本研究探討了重組人血管內皮抑制素(Endostar)與吉西他濱(gemcitabine)不同給藥時序對Lewis肺癌小鼠模型的抗腫瘤效果。研究通過監測腫瘤生長、缺氧狀態、血管內皮生長因子(VEGF)表達、血管周細胞覆蓋(α-SMA標記)及細胞周期分布,發現Endostar與吉西他濱同步給藥(ES+GEM組)顯著抑制腫瘤生長,改善腫瘤缺氧,降低VEGF表達,增強血管正常化,并誘導細胞周期阻滯于G0/G1期,療效優于單藥或序貫給藥。
研究目的
優化聯合治療時序:明確Endostar(抗血管生成藥物)與吉西他濱(化療藥物)的最佳給藥順序(同步或序貫)。
機制驗證:
評估Endostar對腫瘤血管正常化(改善缺氧、增加周細胞覆蓋)的影響;
探究聯合治療對腫瘤細胞周期分布及VEGF表達的影響。
研究思路
模型建立:
構建Lewis肺癌小鼠移植瘤模型(C57BL/6雌鼠,皮下接種Lewis肺癌細胞)。
分組設計(圖1):
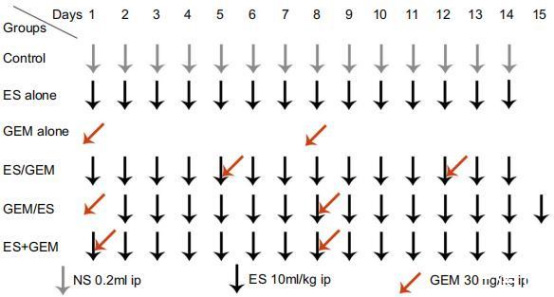
圖1、治療方案。
對照組(無治療)、Endostar單藥組(ES)、吉西他濱單藥組(GEM);
序貫組:Endostar先給后吉西他濱(ES/GEM)、吉西他濱先給后Endostar(GEM/ES);
同步組:Endostar與吉西他濱同時給藥(ES+GEM)。
多指標檢測:
腫瘤體積/重量(圖2A-C,表1);
腫瘤缺氧:丹麥Unisense氧微電極動態監測氧分壓(PO?);
代謝活性:1?F-FDG PET/CT掃描;
血管標志物:免疫組化檢測VEGF和α-SMA;
細胞周期:流式細胞術分析。
測量數據及其研究意義
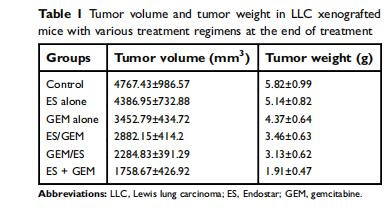
腫瘤體積與重量(圖2A-C,表1):
數據:ES+GEM組腫瘤體積最小(1758.67 mm3,對照組4767.43 mm3),重量最輕(1.91 g,對照組5.82 g)。
意義:同步給藥顯著抑制腫瘤生長,療效優于單藥或序貫給藥(P<0.05)。
腫瘤缺氧改善(圖3):
數據:Unisense電極動態監測顯示,ES+GEM組PO?最高(第5天37.33 mmHg,第15天27.35 mmHg),顯著優于對照組(第5天18.26 mmHg,第15天11.55 mmHg)。
意義:Endostar通過血管正常化改善腫瘤缺氧,為化療增效提供有利微環境。
代謝活性(1?F-FDG PET/CT)(圖4):
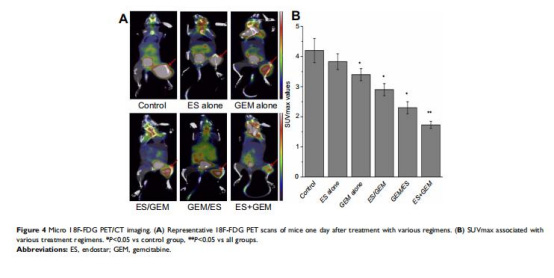
數據:ES+GEM組SUVmax值最低(1.73),顯著低于對照組(4.2)和單藥組(ES組3.83,GEM組3.4)。
意義:低SUVmax反映腫瘤代謝活性下降,提示聯合治療有效抑制腫瘤糖酵解。
血管標志物表達(圖6-7):
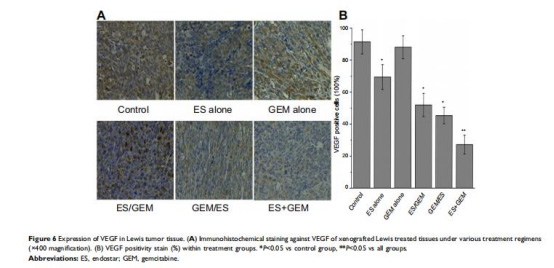
VEGF下調(圖6):ES+GEM組VEGF陽性細胞比例最低(27.18%,對照組91.35%)。
α-SMA上調(圖7):ES+GEM組α-SMA陽性血管最多(10.33條/mm2,對照組4.17條/mm2)。
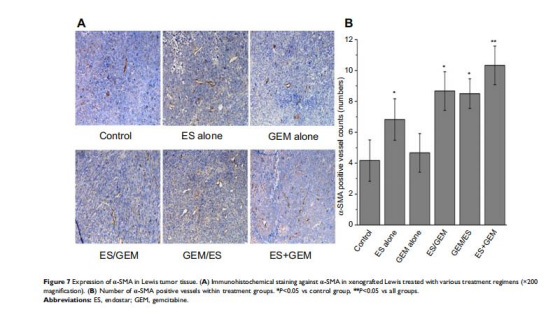
意義:Endostar抑制VEGF促血管生成作用,同時增加周細胞覆蓋(α-SMA),促進血管結構正常化。
細胞周期分布(圖5):
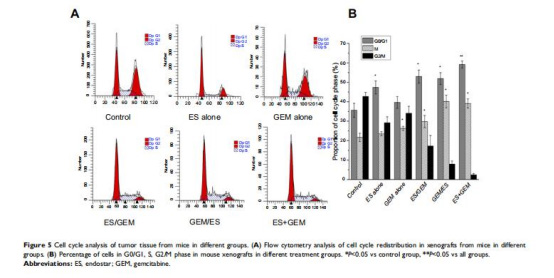
數據:ES+GEM組G0/G1期細胞比例最高(59.16%),S期細胞同步增加(39.09%)。
意義:Endostar誘導G0/G1期阻滯,吉西他濱靶向S期,同步給藥協同增強細胞周期阻滯。
丹麥Unisense電極數據的詳細解讀
技術原理與優勢
原理:Unisense氧微電極直接穿刺腫瘤組織,實時監測局部氧分壓(PO?)。電極尖端通過電化學反應將O?濃度轉化為電流信號,精度達微米級(圖3)。
動態監測:本研究在治療第5、10、15天多次測量PO?(圖3),捕捉血管正常化的時間窗口。

關鍵數據與生物學意義
缺氧改善的時效性:
Endostar單藥組早期(第5、10天)PO?顯著升高(27.06 mmHg),但第15天回落(15.40 mmHg),提示血管正常化窗口短暫。
ES+GEM組全程維持高PO?(第15天27.35 mmHg),證明同步化療可延長血管正常化窗口(圖3)。
指導給藥時序優化:
序貫組(ES/GEM、GEM/ES)PO?改善幅度低于同步組(圖3),從機制上解釋為何ES+GEM組抑瘤效果最佳:持續缺氧改善增強吉西他濱遞送與療效。
臨床轉化價值:
Unisense數據首次證明:Endostar需與化療同步給藥以維持缺氧改善,為臨床方案(如Endostar持續靜脈泵注+化療周期同步)提供實驗依據。
相比間接指標(如HIF-1α IHC),Unisense提供直接、動態的缺氧量化證據,是評估抗血管治療療效的金標準之一。
結論
最佳給藥方案:Endostar與吉西他濱同步給藥(ES+GEM)抑瘤效果最強,機制包括:
顯著改善腫瘤缺氧(PO?↑),延長血管正常化窗口;
協同誘導G0/G1期和S期細胞周期阻滯;
抑制VEGF表達,增強血管周細胞覆蓋(α-SMA↑)。
抗血管聯合化療的機制:Endostar通過血管正常化改善腫瘤微環境(缺氧↓、血管成熟度↑),增強化療藥物遞送與療效。
臨床意義:本研究為“抗血管生成藥物需與化療同步使用”提供關鍵實驗證據,指導肺癌臨床治療方案優化。