熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Morphology engineering for novel antibiotics: Effect of glass microparticles and soy lecithin on rebeccamycin production and cellular morphology of filamentous actinomycete Lentzea aerocolonigenes
新型抗生素的形態工程:玻璃微粒和大豆卵磷脂對絲狀放線菌 Lentzea aerocolonigenes 瑞貝卡霉素生產和細胞形態的影響
來源:Bioeng. Biotechnol. 10.3389/fbioe.2023.1171055
摘要核心內容
本研究首次將 玻璃微顆粒(SiO?基) 引入微顆粒增強培養(MPEC)體系,用于優化絲狀放線菌 Lentzea aerocolonigenes 的瑞貝卡霉素(抗腫瘤抗生素)生產。關鍵發現:
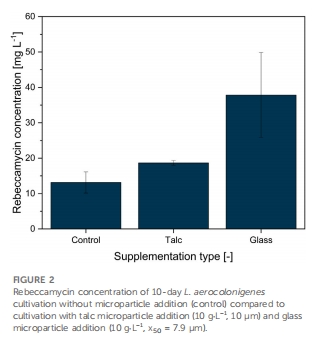
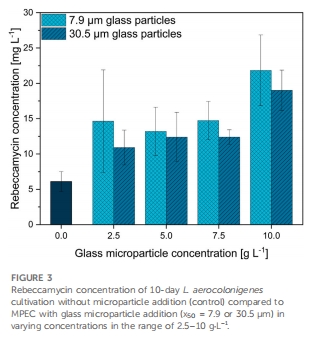
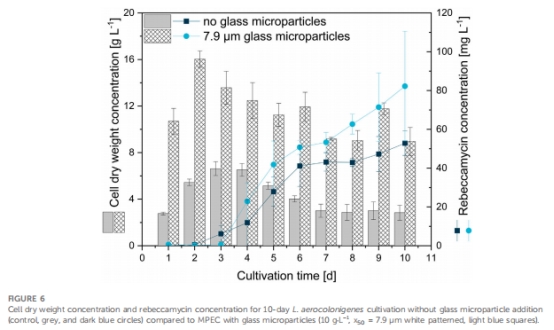
玻璃微顆粒顯著提升產量:添加10 g·L?1玻璃微顆粒(中值粒徑7.9 μm)使瑞貝卡霉素產量提高286%(37.8 mg·L?1 vs 對照13.1 mg·L?1)(圖2)。
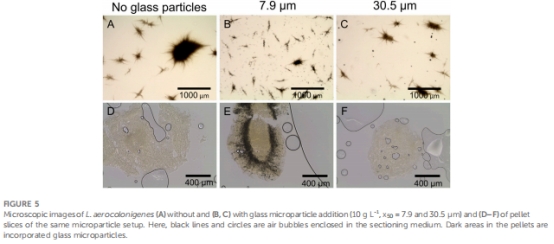
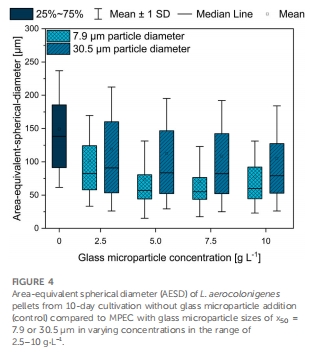
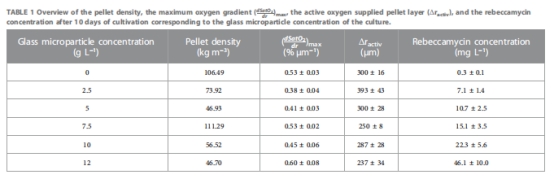
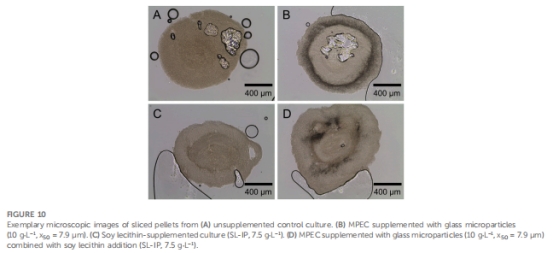
形態調控機制:微顆粒被整合至菌球內部(圖5E),降低菌球密度(表1),減小菌球尺寸(AESD從對照的300 μm降至75 μm)(圖4),改善氧傳遞。
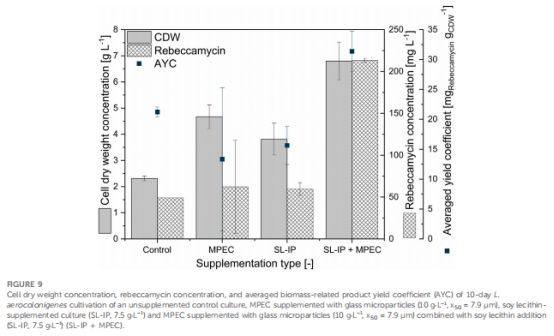
協同增效:聯合添加大豆卵磷脂(7.5 g·L?1)與玻璃微顆粒,產量達 213 mg·L?1(搖瓶培養歷史最高值)(圖9)。
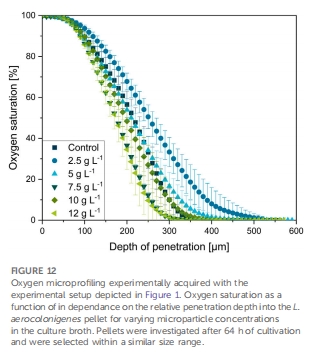
氧傳遞動態:Unisense氧微電極揭示微顆粒增加菌球孔隙率,但代謝活性增強導致氧梯度更陡峭(圖12,表1),挑戰傳統“孔隙率提升供氧”假說。
研究目的
開發新型玻璃微顆粒MPEC體系,替代傳統滑石/氧化鋁顆粒。
解析微顆粒對菌體形態(菌球尺寸、密度、活性)和瑞貝卡霉素合成的調控機制。
探索大豆卵磷脂與MPEC的協同效應,實現產量突破。
研究思路與技術路線
graph TD
A[MPEC體系優化] --> B[玻璃微顆粒篩選]
B --> C[菌球形態與活性分析]
C --> D[氧微剖面測量]
D --> E[聯合大豆卵磷脂驗證]
關鍵實驗設計:
顆粒篩選:對比滑石(10 μm)與兩種玻璃微顆粒(7.9 μm, 30.5 μm),濃度梯度2.5–12 g·L?1(圖3)。
形態分析:激光衍射測菌球尺寸(圖4),CLSM(圖7,10)和切片技術(圖5)觀測微顆粒整合與菌球密度。
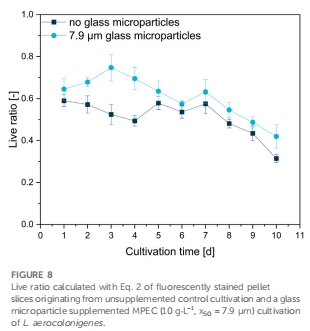
活性監測:SYTO9/PI雙染量化菌球活性(活細胞比率Live Ratio)(圖8)。
氧傳遞解析:Unisense氧微電極(10 μm尖端)測量菌球內部氧梯度(圖12)。
關鍵數據及研究意義
數據類別 來源圖表 研究意義
微顆粒提升產量 圖2,3,9 玻璃微顆粒(7.9 μm)效果優于滑石,確立新型MPEC材料
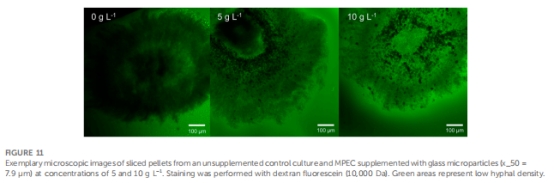
菌球尺寸減小 圖4 微顆粒使菌球AESD↓50%(300→150 μm),改善傳質
微顆粒整合模式 圖5E 顆粒在菌球內部環狀分布,降低密度(表1)
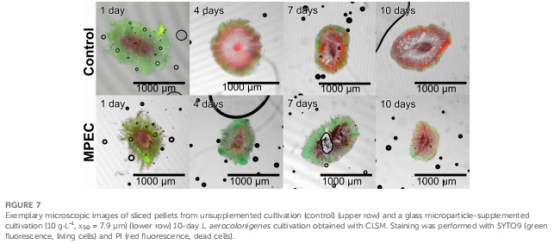
活性維持 圖7,8 MPEC菌球活細胞比率↑40%(0.42 vs 對照0.31),延緩衰亡
氧梯度矛盾現象 圖12, 表1 微顆粒增加孔隙率但氧消耗速率↑,揭示代謝活性主導增產
卵磷脂協同效應 圖9,10 聯合策略產量↑16倍(213 mg·L?1),創搖瓶培養紀錄
核心結論
玻璃微顆粒為高效MPEC材料:7.9 μm顆粒在10 g·L?1時產量提升近3倍,機制為:
菌球尺寸↓ → 比表面積↑
微顆粒整合 → 菌球密度↓(46.93 vs 對照106.49 kg·m?3)
活性維持↑ → 延長生產期
氧傳遞新認知:Unisense微電極顯示MPEC菌球氧梯度更陡(最大梯度0.60%·μm?1 vs 對照0.53%·μm?1),證明代謝活性增強是增產主因,而非單純供氧改善。
協同策略突破瓶頸:MPEC + 大豆卵磷脂(7.5 g·L?1)通過:
卵磷脂乳化作用改善疏水性產物溶解
微顆粒優化形態
→ 產量達213 mg·L?1,為工業化奠定基礎。
Unisense氧微電極數據的深度解讀
技術原理
傳感器類型:Clark型氧微電極(Ox-10,Unisense),尖端直徑10 μm,空間分辨率50 μm。
測量系統:
流動培養槽(玻璃管,流速控制層流)
菌球固定于發絲環,微電極步進式穿透(10 μm/步)
數據采集:SensorTrace Suite軟件(氧飽和度0–100%對應0–265.6 μM O?)
校準:兩點校準(0%飽和度:N?環境;100%飽和度:空氣飽和培養基)。
關鍵發現與意義
氧梯度空間異質性(圖12):
對照菌球:氧飽和度從表面100%降至核心0%的穿透深度為300 μm,梯度0.53%·μm?1。
MPEC菌球(10 g·L?1玻璃顆粒):穿透深度↓至237 μm,梯度↑至0.60%·μm?1。
意義:傳統假說認為孔隙率↑會改善供氧、降低梯度,但數據表明MPEC菌球代謝活性↑導致耗氧加速,梯度反而更陡。
代謝活性主導增產(表1):
微顆粒濃度↑ → 菌球密度↓(孔隙率↑)但氧梯度↑((dSatO?/dr)???從0.53增至0.60%·μm?1)。
活性區域厚度(Δractive)↓(300→237 μm),表明單位體積耗氧率↑。
意義:推翻“孔隙率改善供氧”的單因素理論,證明微顆粒通過激活細胞代謝(而非僅物理傳質)提升產量。
技術革新價值:
首例放線菌菌球氧剖面研究:克服絲狀細菌菌球纖弱的技術挑戰。
動態環境模擬:流動培養槽 + 層流設計逼近真實發酵條件,數據更可靠。
機制解析:明確MPEC增產的核心是代謝激活,指導后續工藝優化(如補料策略)。
局限與展望
未解析活性提升的分子機制:需結合轉錄組學驗證代謝通路激活。
流動槽非無菌環境:改用惰性介質避免雜菌干擾(見2.6節)。
建議:聯用pH/葡萄糖微電極,多參數解析營養梯度。
結論
玻璃微顆粒MPEC通過整合至菌球內部(降低密度、減小尺寸)和激活細胞代謝,顯著提升瑞貝卡霉素產量。Unisense氧微電極揭示 代謝活性增強(而非單純供氧改善)是增產核心機制。聯合大豆卵磷脂的協同策略突破產量瓶頸,為抗生素生產工藝創新提供新范式。