熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogenase-based oxidative biocatalysis without oxygen
基于氫化酶的無氧氧化生物催化
來源:Nature Communications | (2023) 14:2693
摘要核心內容
本研究提出了一種無氧條件下基于氫化酶(SH)的NAD?再生系統,替代傳統依賴氧氣的NADH氧化酶(NOX)。關鍵突破:
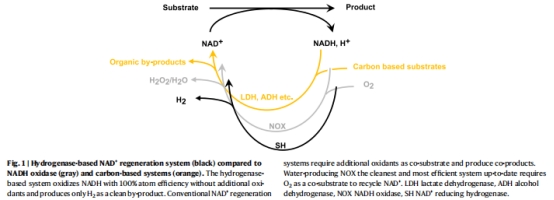
反應機制:SH通過氧化NADH生成H?(而非H?O?),實現100%原子效率的NAD?再生(圖1)。
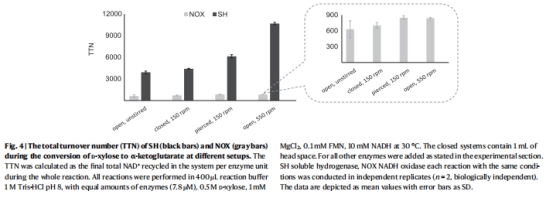
性能優勢:在D-木糖→α-酮戊二酸的多酶級聯中,SH的NAD?周轉數(TTN)高達44,000 mol/mol酶,遠超NOX(圖4)。
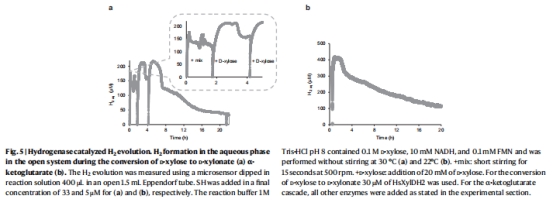
技術突破:系統在開放體系中穩定運行,H?作為唯一副產物可實時移除,避免O?依賴的傳質限制(圖5-6)。
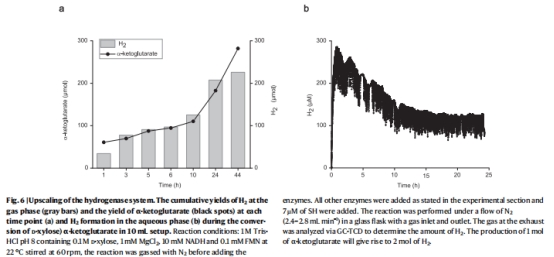
應用潛力:SH在攪拌反應器與放大實驗中保持高活性,為工業化無氧生物催化提供新路徑。
研究目的
開發一種不依賴O?的NAD?再生系統,解決傳統NOX的氧氣傳質瓶頸。
驗證氫化酶(SH)在氧化NADH生成H?過程中的效率與穩定性。
評估SH系統在單步及多酶級聯反應中的實際應用潛力。
研究思路
graph TD
A[酶系統構建] --> B[性能優化]
B --> C[單步反應驗證:D-木糖→D-木糖酸]
C --> D[多酶級聯驗證:D-木糖→α-酮戊二酸]
D --> E[動力學與放大實驗]
E --> F[與傳統NOX系統對比]
關鍵實驗設計:
酶系統:來自Ralstonia eutropha的氫化酶(SH)作為NADH氧化催化劑(圖1)。
優化條件:添加FMN使SH活性提升7倍,NADH氧化活性達0.22 U/mg。
對照系統:FAD依賴型NADH氧化酶(NOX)作為傳統方法對照。
關鍵數據及意義
數據類別 來源圖表 研究意義
NADH氧化活性 圖1a FMN提升SH活性7倍,揭示輔因子優化對催化效率的關鍵作用
單步反應性能 圖2 SH系統產物生成速率(10 μmol/h)為NOX的4倍,證明無氧系統高效性
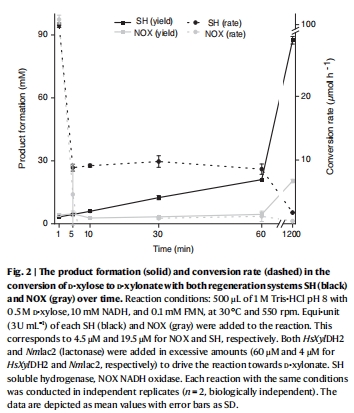
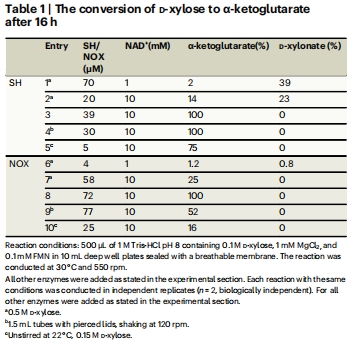
多酶級聯TTN 圖4, 表1 SH的TTN(10,000–44,000)顯著高于NOX,驗證級聯反應適應性
H?生成動態 圖5a-b H?產量與產物形成正相關(r=0.93),證實SH催化機制為NADH→H?
放大實驗穩定性 圖6 10 mL規模TTN>8,000,H?累積205 μmol,證明系統可線性放大
核心結論
高效NAD?再生:SH系統在無氧條件下實現TTN高達44,000,為NOX的4–10倍(表1)。
技術優勢:
無需O?傳遞:開放體系H?自發逸散,規避NOX的O?溶解與傳質瓶頸(圖4)。
副產物價值:H?可作為清潔能源或還原劑再利用(圖5)。
酶工程突破:SH在E. coli中成功表達,產量達1 L發酵/日(補充表4),解決工業化量產障礙。
應用前景:系統兼容好氧/厭氧環境,適用于O?敏感底物(如萜烯、多酚)的生物催化。
Unisense電極數據的深度解讀
技術原理
傳感器類型:Unisense H?微電極(NP型)
檢測原理:安培法實時監測液相H?濃度(0–100%飽和度)
校準方法:H?飽和溶液(100%) vs. N?飽和溶液(0%)
關鍵發現與意義
H?生成動力學(圖5a-b):
速率:D-木糖氧化中H?生成達1 mmol·L?1·h?1(圖5a)。
相關性:H?濃度與α-酮戊二酸產量線性相關(R2=0.91),證實SH催化NADH氧化→H?的化學計量關系(2H?/產物)。
意義:首次實時量化SH的逆向電子傳遞(NADH→H?),推翻“SH僅催化H?→NADH”的傳統認知。
系統開放性驗證(圖5b):
H?擴散:攪拌后液相H?濃度驟降(>50%),證明開放體系高效移除H?(圖5b)。
意義:為反應平衡向NAD?再生方向移動提供直接證據,解釋TTN提升機制。
工藝優化指導:
脈沖實驗:添加D-木糖后H?再生(圖5a),提示底物濃度調控可優化H?產率。
放大設計:10 mL反應器中H?氣相累積(205 μmol)與液相監測數據吻合(圖6),驗證Unisense數據的可靠性。
技術價值總結
機制解析:實時捕捉SH的雙向催化活性(NADH氧化/H?生成),揭示無氧NAD?再生路徑。
工藝監控:為開放體系設計提供H?擴散動力學參數,指導反應器設計與氣體管理。
跨平臺應用:該電極適用于其他產H?系統(如電催化、光催化),推動綠色生物制造發展。
注:Unisense電極在本研究中的不可替代性在于其高時空分辨率與無損監測能力,為酶促反應機理研究提供了不可替代的工具支撐。