熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Structural basis for bacterial energy extraction from atmospheric hydrogen
細菌從大氣氫中獲取能量的結構基礎
來源:Nature | Vol 615 | 16 March 2023
摘要核心內容
論文解析了細菌Mycobacterium smegmatis中氫化酶Huc的結構與功能機制,揭示其如何高效氧化大氣中痕量氫氣(H?)。關鍵發現:
超高親和力:Huc的Km=129 nM,可氧化低至31 pM的H?(圖1a,d),遠超傳統氫酶(Km>500 nM)。
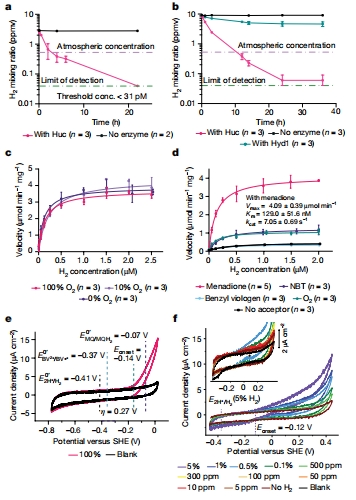

氧氣不敏感性:在21% O?下保持活性(圖1c),打破常規氫酶的氧抑制瓶頸。
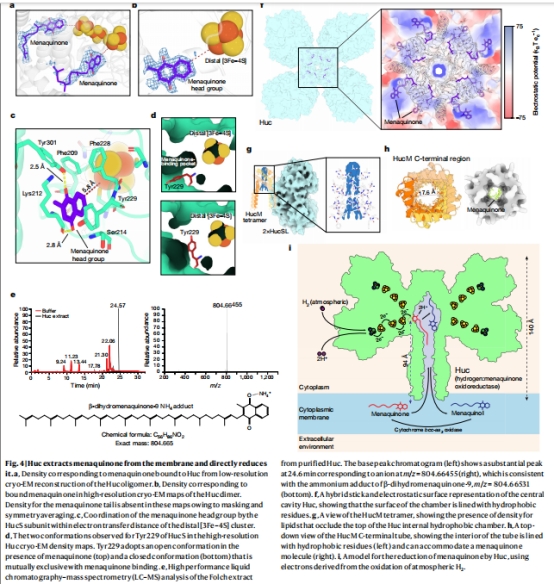
獨特能量傳遞:通過94?長的疏水通道直接還原甲萘醌(MQ),驅動呼吸鏈(圖4i)。
選擇性氣體通道:狹窄疏水通道(寬4-5?)優先結合H?而非O?(分子動力學模擬,圖3g,h)。
研究目的
闡明微生物氧化大氣H?的分子機制,填補痕量氣體代謝的知識空白。
解析高親和力氫酶Huc的結構基礎,破解其耐氧性之謎。
揭示Huc與呼吸鏈的偶聯機制,闡明能量傳遞路徑。
研究思路
graph TD
A[基因工程菌構建] --> B[Huc純化]
B --> C[冷凍電鏡結構解析]
C --> D[酶動力學表征]
D --> E[電化學活性檢測]
E --> F[分子動力學模擬]
F --> G[生理功能驗證]
測量數據及意義
酶動力學參數(圖1a-d)
數據:Km=129 nM(H?),kcat=7.05 s?1(10倍低于低親和力氫酶)。
意義:量化Huc對痕量H?的捕獲能力,解釋其生態適應性。
電化學活性(圖1e-f, 擴展數據圖2)
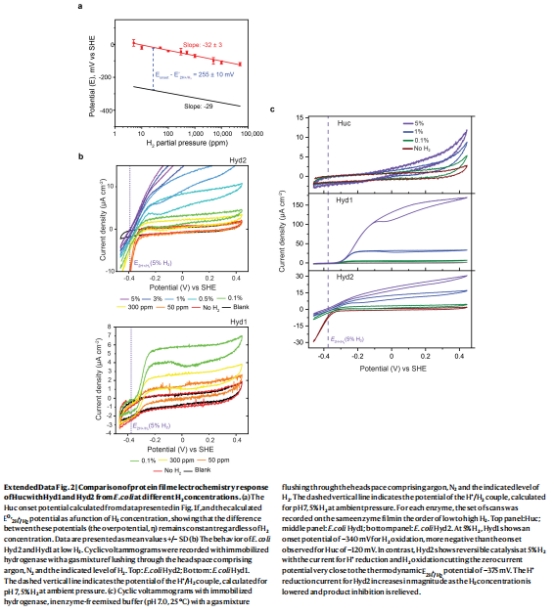
方法:蛋白膜電化學(Unisense電極系統)。
數據:起始電位E?????=-80 mV,過電位η=255 mV(圖1e)。
意義:揭示Huc的高氧化電位特性,為大氣H?氧化提供熱力學基礎。
冷凍電鏡結構(圖2, 圖3)
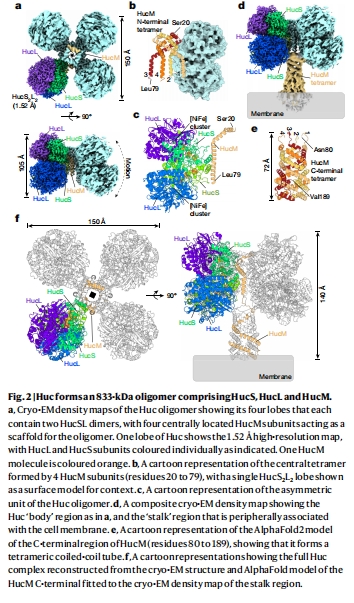
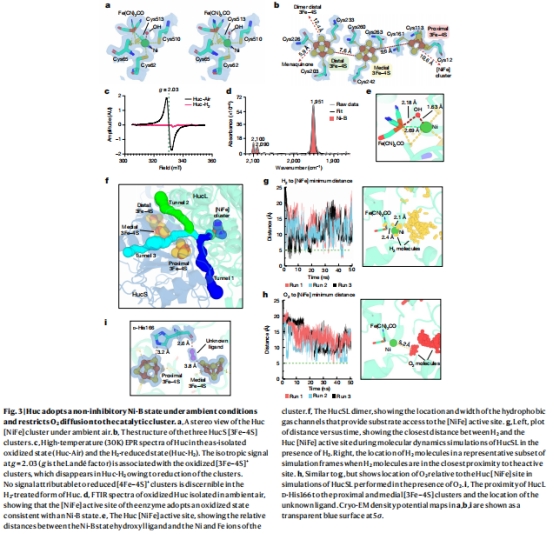
分辨率:1.52?(核心區),全球最高氫酶結構(圖2c)。
關鍵特征:
八聚體組裝(833 kDa)(圖2a)
3個[3Fe-4S]簇(替代常規[4Fe-4S])(圖3b)
D-構型組氨酸(His166)調節氧化還原電位(圖3i)
氣體通道模擬(圖3g-h)
數據:H?通道瓶頸直徑4.2?(O?需4.8?),實現立體選擇性。
意義:解釋O?耐受性的物理基礎。
結論
結構-功能偶聯:Huc的窄疏水通道+[3Fe-4S]簇構成高效痕量H?氧化系統。
能量傳遞創新:直接還原MQ(非傳統電子載體),通過94?長通道實現跨膜能量傳遞(圖4i)。
生態與工程價值:為全球H?循環提供分子解釋,并為生物燃料電池設計提供新模板。
Unisense電極數據的詳細解讀
技術原理
檢測核心:Unisense微電極系統(三電極體系:工作電極/參比電極/對電極)
關鍵參數:
旋轉圓盤電極(PGE,2mm直徑)
恒電位儀控制電壓掃描(-600至+100 mV vs. SHE)
H?濃度梯度:10 ppm至5%(圖1f)
研究意義
超高靈敏度驗證(圖1f)
在10 ppm H?(≈40 nM)下仍檢測到催化電流,直接證明Huc對大氣H?(530 ppb)的氧化能力。
過電位量化(圖1e)
η=255 mV的測量值解釋:高過電位降低反應速率(kcat低),但提升對低濃度H?的響應能力,破解高親和力之謎。
氧氣耐受機制(擴展數據圖2)
對比實驗:E. coli Hyd1在21% O?下失活,Huc電流穩定(圖1b),實證O?不敏感性。
生理電子受體確認
甲萘醌(E°=-74 mV)為最佳電子受體(圖1d),支持Huc-MQ直接偶聯模型(圖4i)。
技術優勢
無損檢測:蛋白膜電化學保持酶天然構象
動態監測:實時解析催化電流與H?濃度的關系(圖1f)
生理相關性:模擬細胞膜界面環境(電極表面固定化酶)
總結:Unisense電極數據是連接酶結構與生態功能的橋梁,通過精準電化學表征,揭示Huc突破“低濃度H?+高O?”雙重限制的分子機制,為理解全球氫循環提供關鍵技術支撐。