熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Plant-Pathogenic Ralstonia Phylotypes Evolved Divergent Respiratory Strategies and Behaviors To Thrive in Xylem
植物致病性 Ralstonia 系統型進化出不同的呼吸策略和行為,在 Xylem 中茁壯成長
來源:January/February 2023 Volume 14 Issue 1
1. 摘要核心內容
核心發現:
青枯菌復合體(RSSC)的四個系統發育群(I-IV)在番茄木質部定殖時演化出兩種呼吸代謝策略:
完全反硝化型(Phylotype I/III):通過完整的反硝化途徑(NO?? → N?)在低氧環境中高效生長,依賴終末酶NosZ(圖1C),形成厚生物膜(圖6),占據缺氧微環境。
部分反硝化型(Phylotype II/IV):缺乏NosZ(NO?? → N?O),不依賴反硝化途徑獲取能量,在木質部以浮游狀態為主(圖6A),但致病力未減弱。
生理差異:
完全反硝化型在低氧下生長更優(圖3A),對低氧環境有趨性,生物膜更厚(圖6B)。
部分反硝化型在缺氧下生長不受硝酸鹽影響(圖3A),形成生物膜能力弱(圖6)。
生態意義:兩類菌在相同生境(木質部)中通過代謝分區(niche partitioning) 共存。
2. 研究目的
解析RSSC不同系統發育群在木質部定殖的呼吸代謝策略差異。
探究NosZ在完全反硝化型致病中的作用。
揭示反硝化能力差異與生物行為(生物膜、趨氧性)的關聯。
解釋部分反硝化型缺乏NosZ仍保持高致病力的機制。
3. 研究思路
基因組分析:
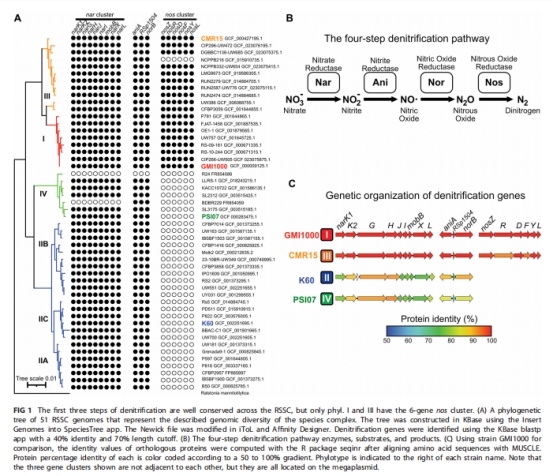
比較51株RSSC菌株的反硝化基因分布(圖1),確認NosZ僅在Phylotype I/III中存在。
功能驗證:
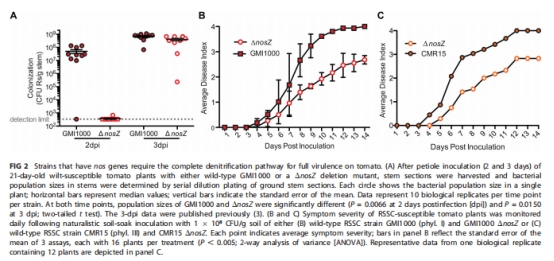
構建Phylotype I(GMI1000)和III(CMR15)的ΔnosZ突變體,驗證其對番茄致病力的影響(圖2)。
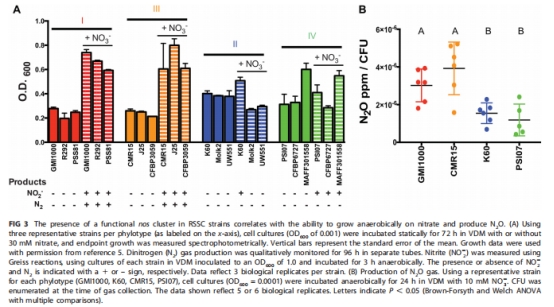
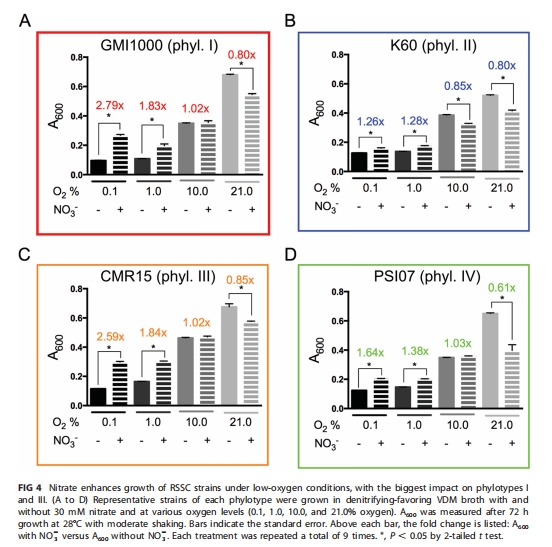
測定四類代表菌株在缺氧/低氧下的生長(圖3A, 圖4)、N?O產量(圖3B)及生物膜形成(圖6B)。
行為分析:
軟瓊脂遷移實驗檢測趨氧性。
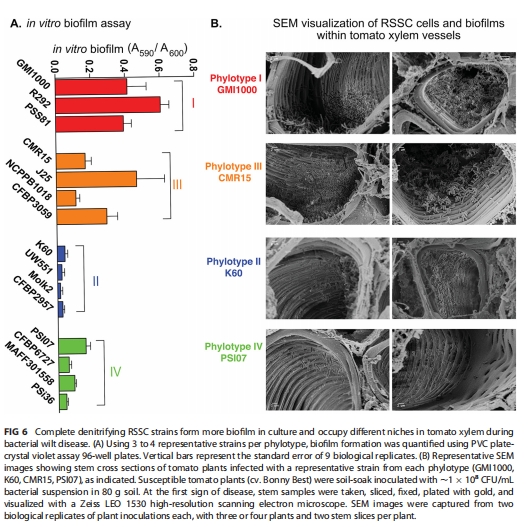
掃描電鏡觀察木質部定殖模式(圖6A)。
環境監測:
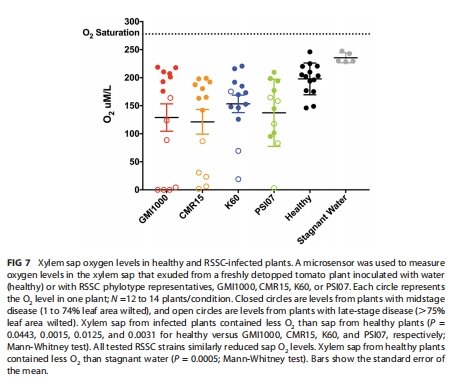
Unisense微電極直接測量感染后木質部汁液氧濃度(圖7)。
組學分析:
KEGG富集分析揭示芳香族代謝通路差異(圖5)。

4. 測量數據及其意義
關鍵數據與來源
數據類型 來源圖表 研究意義
反硝化基因分布 圖1C 僅Phylotype I/III含完整nos基因簇,解釋其N?生產能力(圖3A)及缺氧生長優勢。
ΔnosZ致病力缺陷 圖2 NosZ是Phylotype I/III的毒力因子(ΔnosZ突變體在番茄莖內種群下降30-50%)。
缺氧生長與N?O產量 圖3A-B Phylotype I/III在缺氧下依賴NO??生長(3-4倍↑),N?O產量為部分反硝化型2倍(P=0.0065)。
低氧生長響應 圖4 Phylotype I/III在1% O?下NO??促生長效應最強(A???提升2.5倍),部分反硝化型響應弱。
生物膜形成能力 圖6B Phylotype I/III生物膜厚度顯著高于II/IV(PVC板實驗,P<0.05),支持其缺氧適應策略。
木質部定殖模式 圖6A 電鏡顯示Phylotype I/III形成厚生物膜堵塞導管,II/IV以單層細胞附著為主。
木質部氧濃度動態 圖7 Unisense電極證實所有菌株感染均降低木質部O?(健康植株≈200 μM → 病株晚期≈0-175 μM),但菌株間無差異,暗示微環境異質性。
芳香族代謝通路分布 圖5 Phylotype II/IV富集苯甲酸降解途徑(Ben/Cat),I/III富集部分Dmp途徑,提示碳源利用差異。
5. 核心結論
呼吸策略分化:
Phylotype I/III通過完全反硝化(NosZ依賴)在低氧木質部生成ATP,生物膜增厚增強缺氧適應性。
Phylotype II/IV采用部分反硝化(至N?O)或高氧親合途徑,以浮游狀態適應較高氧微環境。
致病力解耦:
盡管缺乏NosZ,Phylotype II/IV在番茄中達到同等高種群密度(>10? CFU/g莖),致病力不減(圖2),說明存在替代能量獲取機制。
生態位分區:
完全反硝化型占據生物膜內部缺氧區,部分反硝化型占據導管中央較高氧區,共生于同一宿主。
進化意義:
nos基因簇水平轉移至Phylotype I/III,而II/IV丟失該功能,反映對不同土壤環境(如淹水耐受)的適應。
6. Unisense電極數據的深度解讀
測量方法
技術:Unisense氧微電極(OP-MR)直接插入番茄莖切口滲出汁液(圖7)。
條件:活體植株自然根壓滲出,避免離體干擾。
指標:實時監測木質部汁液溶解氧濃度(μM),區分健康/感染植株(早/晚期病程)。
關鍵結果(圖7)
健康植株:木質部氧濃度≈200 μM(顯著低于停滯水230 μM,P=0.0005)。
感染植株:
早中期病程(DI=1-3):氧降至95-220 μM。
晚期病程(DI>3):氧進一步降至0-175 μM(接近缺氧)。
四類菌株感染后氧降幅無差異(P>0.05)。
研究意義
驗證木質部缺氧環境:
首次直接證實RSSC感染主動消耗木質部氧氣(所有菌株均使O?↓50%以上),支持反硝化代謝的生理需求。
揭示微環境異質性:
盡管整體氧濃度無差異,但生物膜電鏡(圖6A)顯示Phylotype I/III形成局部超缺氧微環境,解釋其NosZ依賴性。
技術優勢:
原位實時監測:活體植物動態數據,克服離體實驗的氧氣擴散失真。
高空間分辨率:微電極尖端(μm級)捕捉木質部導管內氧梯度,為“生物膜內部缺氧”假說提供間接證據。
生態相關性:直接關聯病原體行為與宿主環境變化,證實病程中氧氣是動態限制因子。
對病原代謝研究的價值
該數據闡明:盡管整體氧環境相似,但菌株定殖策略(生物膜vs浮游)導致局部微環境分化,驅動呼吸代謝的進化分化。Unisense電極是解析宿主-病原互作中微環境異質性的關鍵工具。
總結:本研究通過整合基因組學、生理表型與Unisense原位監測,揭示青枯菌通過呼吸策略分化實現生態位分區。完全反硝化型(I/III)依賴NosZ在生物膜缺氧區高效生長,部分反硝化型(II/IV)采用替代策略占據富氧區,二者共存于同一宿主。Unisense電極數據為木質部氧動態提供直接證據,奠定微環境適應性進化研究的基石。