熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Mild hypoxia-induced structural and functional changes of the hippocampal network
輕度缺氧誘導的海馬網絡結構和功能變化
來源:Frontiers in Cellular Neuroscience, Volume 17, Article 1277375, Published 29 September 2023.
《細胞神經科學前沿》第17卷,文章編號1277375,2023年9月29日發表
摘要內容
研究通過體內實驗探究輕度短期缺氧(16% O?持續1小時)對大鼠海馬網絡的影響。主要發現:
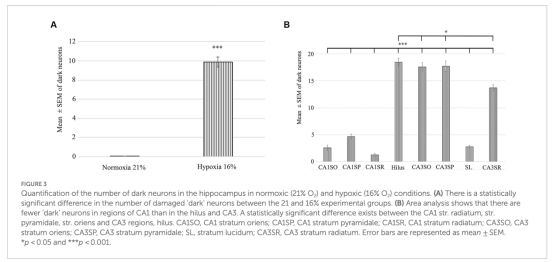
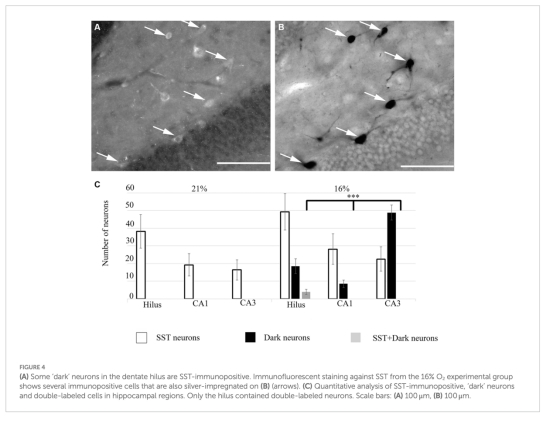
結構損傷:Gallyas銀染法顯示缺氧導致海馬門區(hilus)生長抑素(SST)陽性抑制性神經元出現“暗神經元”(退化早期標志),CA3區損傷最顯著(圖2-3)。

電生理變化:
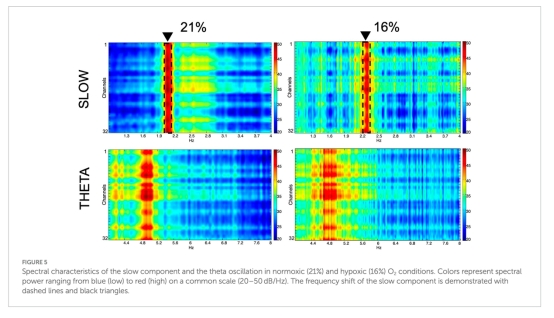
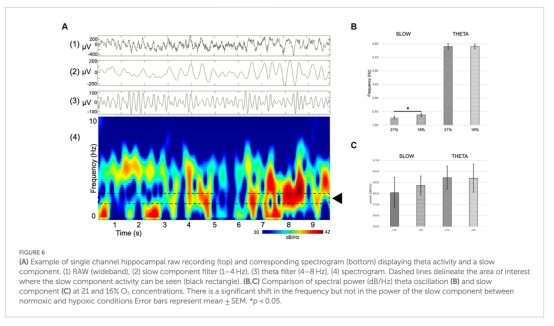
網絡振蕩:慢波頻率從2.18Hz增至2.28Hz(p<0.05),θ/β/γ波段功率無變化(圖5-6)。
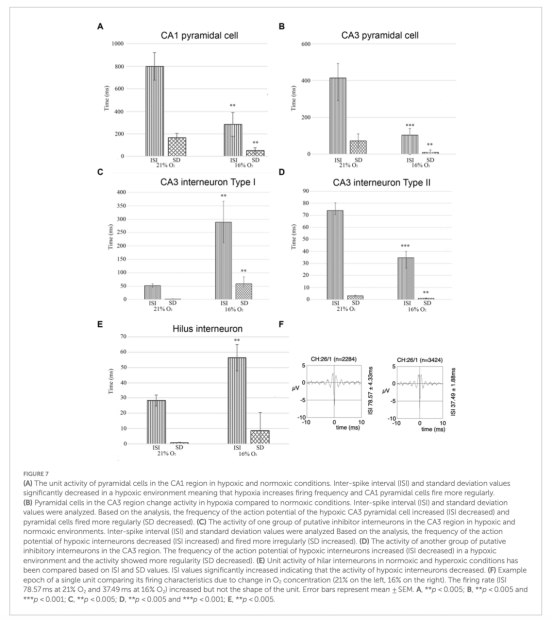
單元活動:CA1和CA3區錐體神經元放電頻率增加;門區中間神經元放電頻率降低;CA3區抑制性神經元呈現異質性響應(部分頻率降低,部分升高)(圖7,表1)。

機制關聯:缺氧通過改變離子通道活性和突觸傳遞,破壞興奮-抑制平衡,影響信息處理能力。
研究目的
闡明輕度缺氧對海馬神經元結構和功能的急性影響。
確定特定神經元亞型(如SST陽性中間神經元)對缺氧的敏感性。
解析缺氧對海馬網絡振蕩(如慢波、θ波)和單細胞電活動的調控機制。
研究思路
動物模型:
40只雄性Wistar大鼠,分為常氧組(21% O?)和缺氧組(16% O?),持續1小時。
多模態評估:
組織學:Gallyas銀染檢測“暗神經元”;免疫組化標記SST、PV、NPY等中間神經元亞型(圖2-4)。 、
電生理:32通道硅探針記錄麻醉狀態下海馬各層網絡振蕩和單細胞放電(圖5-7)。
氧監測:Unisense O?微電極實時監測海馬組織氧分壓(圖1A)。
數據分析:

神經元損傷定量(Image-Pro軟件);頻譜分析(Matlab);單細胞分類(放電間隔ISI和標準差SD)。
測量數據、來源及研究意義
組織氧分壓(圖1A):
數據:缺氧組海馬氧分壓從20.1 mmHg降至8.71 mmHg(p<0.005)。
意義:直接量化缺氧程度,為后續病理/生理變化提供環境基準。
“暗神經元”數量(圖3):
數據:缺氧組CA3區暗神經元數量顯著高于常氧組(CA3 str. pyramidale: 17.57±5.26 vs. 對照組≈0)。
意義:表明CA3區錐體神經元和門區SST陽性中間神經元對缺氧敏感(圖4)。
慢波頻率偏移(圖6A):
數據:慢波峰值頻率從2.18Hz升至2.28Hz(p<0.05),功率無變化。
意義:提示缺氧特異性影響慢波振蕩,可能關聯睡眠-覺醒周期紊亂。
單細胞放電變化(圖7,表1):
數據:
CA1錐體神經元:ISI從800.15ms降至284.67ms(放電加速)。
門區中間神經元:ISI從28.24ms增至56.31ms(放電抑制)。
意義:揭示神經元亞型對缺氧的異質性響應,CA3區中間神經元分化為抑制型(Type I)和興奮型(Type II)群體。
結論
結構損傷:輕度缺氧選擇性損傷海馬門區SST陽性中間神經元和CA3錐體神經元(圖2-4)。
網絡功能紊亂:
慢波頻率增加可能反映丘腦-皮層通路異常(圖6)。
錐體神經元過度興奮與中間神經元抑制失衡,可能導致癲癇樣活動(圖7)。
臨床意義:短期輕度缺氧(如高原反應、睡眠呼吸暫停)可能損害海馬依賴的學習記憶功能。
丹麥Unisense電極測量數據的研究意義
實驗中采用Unisense OX-10微氧電極(方法章節)監測海馬組織氧分壓,其核心價值在于:
高時空精度:
10μm針尖可定位記錄海馬特定分層(如CA1門區),避免整體組織平均值掩蓋微區域差異。
動態過程捕捉:
實時顯示氧分壓從20.1→8.71 mmHg的陡降曲線(圖1A),為電生理記錄的“缺氧時間窗”提供同步標尺。
技術不可替代性:
傳統氧電極無法在體記錄深部腦區微環境,Unisense微電極的極譜技術(Clark型)保障了在麻醉動物中的穩定測量。
機制關聯性:
氧分壓數據與神經元放電變化(如CA1錐體細胞興奮性增高)直接關聯,支持“缺氧→線粒體功能障礙→離子通道失調”的病理鏈條。