熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hyperbaric Oxygen Boosts Antitumor Efficacy of Copper-Diethyldithiocarbamate Nanoparticles against Pancreatic Ductal Adenocarcinoma by Regulating Cancer Stem Cell Metabolism
高壓氧通過調節癌癥干細胞代謝增強銅-二乙基二硫代氨基甲酸酯納米顆粒對胰腺導管腺癌的抗腫瘤療效
來源:Research 2024;7:Article 0335
《研究》2024年第7卷第0335號文章
摘要內容:
摘要指出銅死亡(cuproptosis)納米藥物在胰腺導管腺癌(PDAC)治療中因癌癥干細胞(CSCs)的缺氧微環境和糖酵解代謝而受限。研究通過高壓氧(HBO)克服腫瘤缺氧,將CSCs代謝從糖酵解重編程為氧化磷酸化(OXPHOS),同時利用銅-二乙基二硫代氨基甲酸酯納米顆粒(CuET@PH NPs)靶向三羧酸(TCA)循環蛋白誘導銅死亡。體外和體內實驗表明,HBO與CuET@PH NPs聯用顯著抑制CSCs能量代謝,清除CSCs,并有效抑制腫瘤生長和延長生存期。
研究目的:
解決銅死亡納米療法在PDAC中因缺氧微環境和CSCs代謝可塑性導致的療效受限問題,探索HBO調控CSCs代謝以增強CuET@PH NPs抗腫瘤效果的機制。
研究思路:
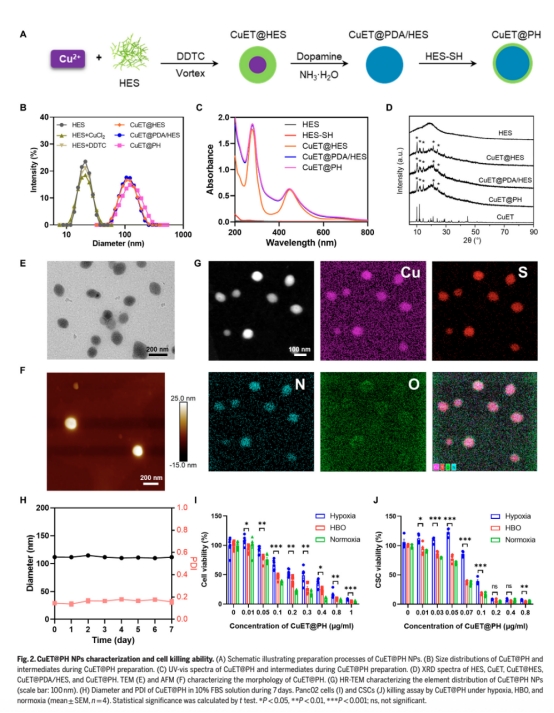
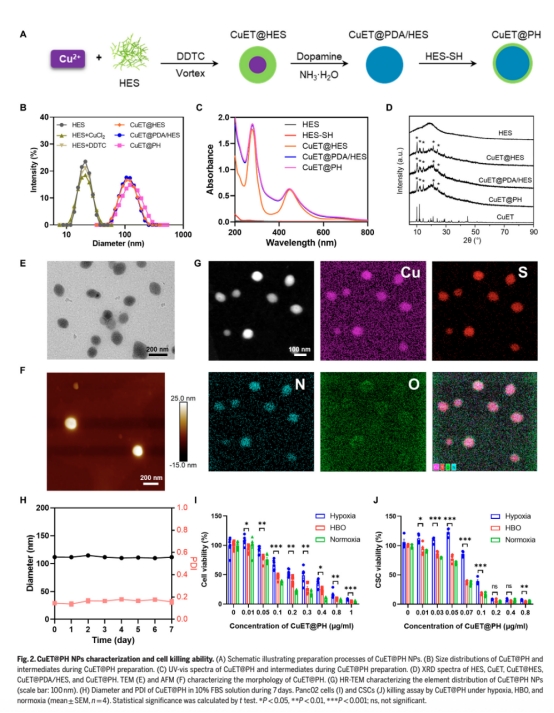
納米顆粒設計與優化:合成聚多巴胺和羥乙基淀粉穩定的CuET@PH NPs(圖2A),提升系統給藥穩定性。
代謝調控機制驗證:
體外實驗:在缺氧、常氧和HBO條件下,分析CuET@PH NPs對PDAC CSCs代謝通路(糖酵解/OXPHOS)的影響(圖3-5)。
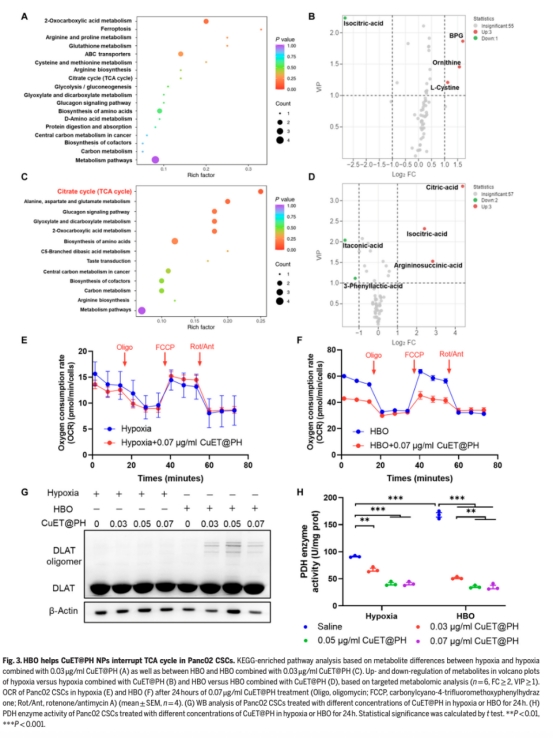
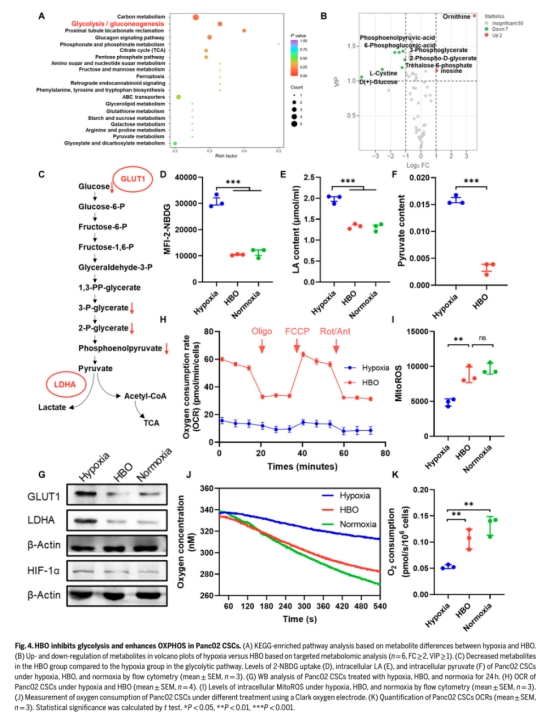
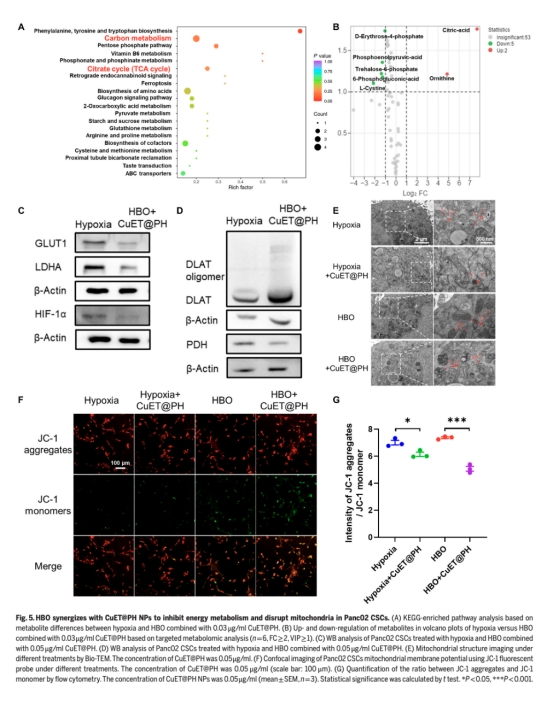
機制探索:通過靶向代謝組學、線粒體呼吸(OCR)、蛋白表達(WB)等闡明HBO如何逆轉缺氧并增強CuET@PH NPs對TCA循環的破壞。
體內療效評價:
建立原位PDAC小鼠模型,驗證HBO增強CuET@PH NPs腫瘤靶向性。
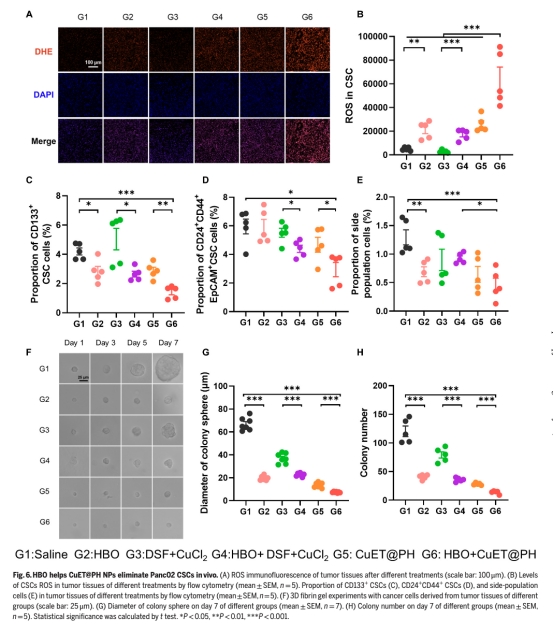
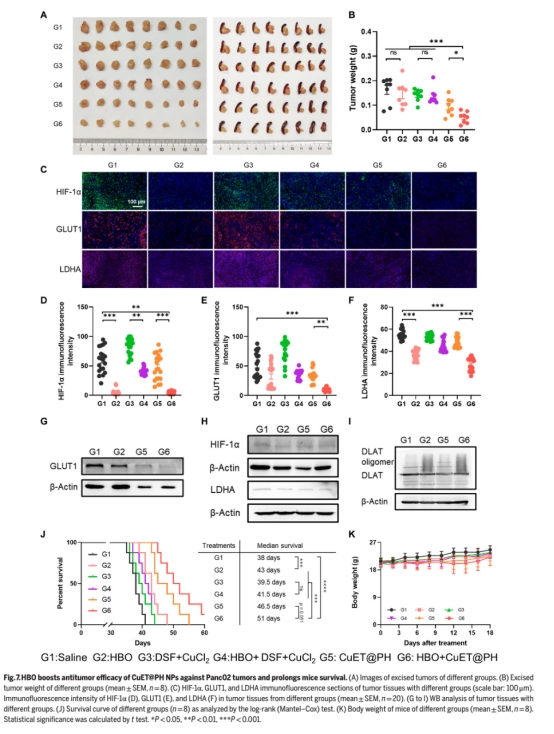
分析聯合治療對CSCs清除(圖6)、腫瘤生長抑制(圖7A-B)及生存期延長(圖7J)的作用。
測量數據及研究意義:
納米顆粒表征(圖2B-G 如下):尺寸(122 nm)、電位(-10.8 mV)、元素分布及穩定性,證明CuET@PH NPs適合系統給藥。
細胞毒性(圖2I-J,):HBO使CuET@PH NPs對CSCs的IC50從缺氧下的0.086 μg/ml降至0.064 μg/ml,證實HBO逆轉缺氧耐藥。
代謝組學(圖3-5):
HBO顯著下調糖酵解產物(D-葡萄糖、乳酸等),上調TCA循環代謝物(檸檬酸)。
CuET@PH NPs在HBO下誘導DLAT蛋白寡聚化(圖3G, 5D),破壞線粒體功能。
線粒體功能(圖3E-F, 4H):
HBO提升CSCs基礎呼吸(3.82倍)和最大呼吸(4.43倍)。
CuET@PH NPs在HBO下抑制線粒體備用呼吸能力(47.3%)。
丹麥Unisense電極數據(圖4J-K):
測量結果:直接檢測細胞耗氧速率(OCR),顯示HBO組CSCs耗氧量顯著高于缺氧組。
研究意義:首次在單細胞水平證實HBO將CSCs代謝從糖酵切換至OXPHOS,為銅死亡納米療法增效提供直接生理證據,避免間接代謝推算的偏差。
體內效果(圖6-7如下):
HBO使CuET@PH NPs腫瘤蓄積提升2.58倍,CSCs內ROS增加12.79倍(圖6B如下)。
聯合治療降低CSCs比例(CD133+細胞減少66.3%,圖6C如下)并抑制腫瘤球形成(圖6F-H如下)。
協同下調HIF-1α/GLUT1/LDHA蛋白(圖7C-G如下),延長小鼠中位生存期(圖7J如下)。
結論:
HBO通過抑制HIF-1α通路下調GLUT1/LDHA,阻斷CSCs糖酵解,逆轉缺氧微環境。
CuET@PH NPs在OXPHOS主導的代謝狀態下有效破壞TCA循環,誘導DLAT寡聚化和線粒體損傷(圖5E-F)。
HBO與CuET@PH NPs協同抑制CSCs能量代謝(雙通路阻斷),清除CSCs并抑制腫瘤生長(TIR達69%)。
該聯合策略為PDAC臨床治療提供新思路,尤其適用于靶向代謝可塑性的耐藥腫瘤。