熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
來源:PLOS ONE July 25, 2024
摘要核心內容
論文開發了一種名為 IOPC(Intestinal Organoid Physoxic Coculture) 的新型共培養系統,用于在生理氧條件下(模擬腸道內低氧環境)共培養人類腸道類器官(HIOs)與厭氧腸道細菌。該系統通過簡單、低成本的裝置,在類器官基底側維持生理性低氧(physoxia,5.6% O?),在頂側(腔面)維持厭氧環境,成功支持了厭氧菌(如 Bacteroides thetaiotaomicron 和 Blautia sp.)與HIOs共培養24-48小時。研究證實IOPC能增強腸道屏障完整性,調節免疫基因表達,并揭示不同供體來源的HIOs對細菌的響應存在差異。
研究目的
解決關鍵矛盾:腸道上皮細胞需氧生長 vs. 腸道細菌多為厭氧菌。
開發新系統:建立低成本、易操作的共培養平臺,模擬體內腸道氧梯度(頂側厭氧/基底側低氧)。
驗證生理相關性:探究生理氧條件對HIOs屏障功能、基因表達及宿主-微生物互作的影響。
研究思路
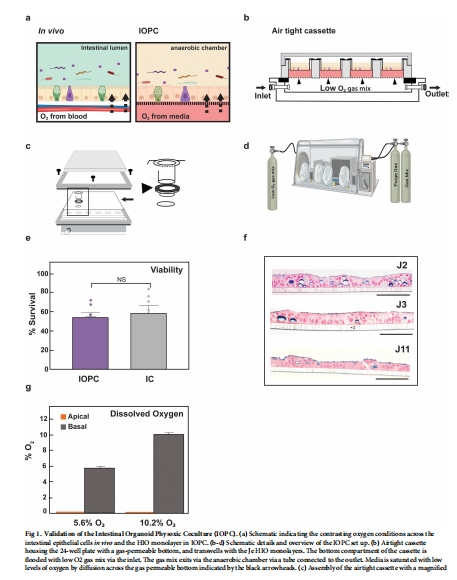
系統設計(圖1B-D):
使用透氣底24孔板,基底側通入低氧混合氣(5% CO?, 5.6% O?, 平衡N?)。
頂側密封于厭氧腔,依賴HIOs代謝消耗殘余氧,創造厭氧環境。
驗證系統:
測量氧氣分布(圖1G)、HIOs存活率(圖1E)和形態(圖1F)。
分析低氧對HIOs屏障功能(TEER)和基因表達的影響(圖2)。
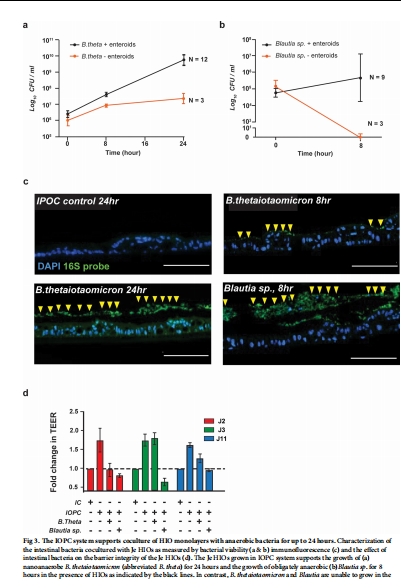
共培養驗證:
接種厭氧菌(B. thetaiotaomicron 和 Blautia sp.),檢測細菌存活(圖3A-C)及對HIOs屏障的影響(圖3D)。
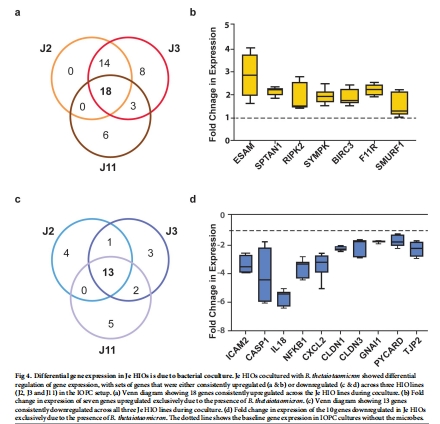
機制探究:
通過RT2 Profiler PCR陣列分析細菌共培養后HIOs的轉錄組變化(圖4)。
測量數據及其意義
1. 氧氣濃度測量(圖1G)
數據:使用丹麥Unisense微電極測量溶解氧:
頂側腔:氧濃度低于檢測限(厭氧)。
基底側:氧濃度與通入氣體一致(5.6%或10.2%)。
意義:
驗證系統核心功能:成功模擬腸道氧梯度(頂側厭氧/基底側低氧)。
揭示HIOs作用:HIOs主動消耗頂側殘余氧(無HIOs時頂側氧濃度為3-4%)。
支持厭氧菌存活:為共培養提供關鍵環境基礎。
2. HIOs存活與形態(圖1E-F)
數據:IOPC培養的HIOs存活率與常規培養無差異;H&E和阿爾新藍染色顯示正常極性和黏液分泌。
意義:證實低氧條件不影響HIOs健康狀態。
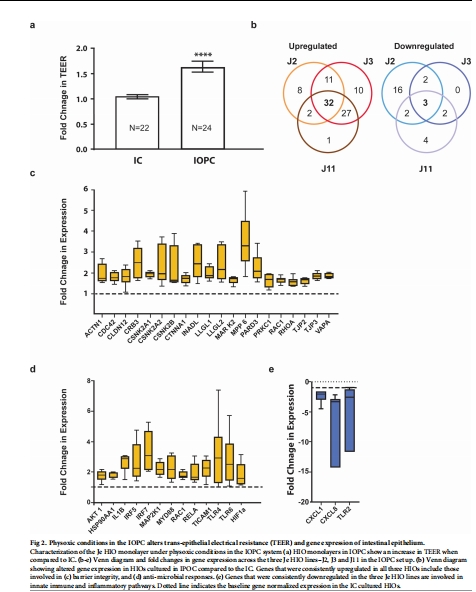
3. 屏障功能(TEER)(圖2A, 圖3D)
數據:
IOPC顯著提升TEER(圖2A)。
共培養后,TEER下降(B. thetaiotaomicron 和 Blautia sp.均降低屏障功能),但存在供體差異(J3對 Blautia 更敏感)。
意義:
生理氧增強腸道屏障。
細菌可調控屏障完整性,且響應具有個體特異性。
4. 基因表達(圖2B-E, 圖4)
數據(RT2 PCR陣列):
僅低氧(IOPC vs. IC):32個基因上調(如屏障相關基因 INADL、PARD3;抗菌基因 TLR4),3個下調(促炎基因 CXCL8/IL8、TLR2)(圖2B-E)。
細菌共培養:18個基因上調(屏障相關 ESAM、F11R),13個下調(炎癥相關 NFKB1、IL18)(圖4)。
意義:
生理氧誘導屏障增強和免疫耐受表型。
細菌共培養進一步調控免疫平衡(抑制炎癥通路)。
5. 細菌存活(圖3A-C)
數據:
B. thetaiotaomicron 在共培養中增殖(24小時),Blautia sp. 存活8小時(圖3A-B)。
FISH證實細菌定植于頂側(圖3C)。
意義:IOPC支持嚴格厭氧菌存活,且細菌生長依賴HIOs代謝。
結論
IOPC系統成功:低成本、易操作的裝置可模擬腸道生理氧梯度,支持厭氧菌與HIOs共培養。
生理氧誘導關鍵表型:增強屏障功能、上調抗菌基因、下調炎癥基因(如 IL8)。
微生物調控宿主:厭氧菌共培養可改變HIOs基因表達,抑制炎癥通路(如 NF-κB)。
個體差異:不同供體HIOs對細菌的響應程度不同(如TEER變化),凸顯個性化研究價值。
應用潛力:為研究腸道宿主-微生物互作、個性化醫療(如FMT)及藥物吸收提供新平臺。
Unisense電極數據的詳細解讀
測量結果(圖1G)
頂側腔:溶解氧 低于檢測限(接近0%),符合厭氧要求。
基底側:溶解氧穩定在 5.6%或10.2%,與通入氣體一致。
對比對照組:無HIOs時頂側氧濃度為3-4%,證明HIOs主動耗氧是維持厭氧的關鍵。
研究意義
驗證系統可靠性:
直接證實IOPC能精確控制氧梯度,為后續生物學結果提供物理基礎。
揭示HIOs的代謝作用:
HIOs不僅是被動屏障,還通過耗氧主動塑造微環境,支持厭氧菌生存。
模擬體內生理:
數據證明系統成功復現了腸道"頂側厭氧/基底側低氧"的生理狀態(體內氧梯度為1-11%)。
解決共培養矛盾:
為"需氧上皮 vs. 厭氧菌"的共存提供了可量化解決方案,克服了傳統培養的局限性。
支持嚴格厭氧菌研究:
頂側持續厭氧使該系統適用于對氧極度敏感的菌(如 Blautia sp.),拓展了可研究的微生物范圍。
關鍵啟示:Unisense電極數據不僅是技術驗證,更揭示了宿主細胞(HIOs)在塑造微生物微環境中的主動角色,強調了宿主-微生物互作的雙向性。
總結:IOPC系統通過創新設計解決了腸道共培養的氧矛盾,結合多維度數據(物理、細胞、基因),為腸道宿主-微生物互作研究提供了高效、生理相關的平臺,并揭示了氧氣微環境對腸道穩態的核心調控作用。