熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
來源:Antioxidants 2024, 13, 1397
摘要核心內容
問題:兒童癌癥幸存者(CCS)雖生存率提高,但面臨早衰風險,與化療/放療的長期效應相關。
發現:CCS的單核細胞(MNCs)存在抗氧化防御受損(谷胱甘肽通路酶活性降低)和氧化損傷累積(脂質、DNA、蛋白質損傷),類似老年人水平。機制上由Nrf2表達下調驅動。
干預:N-乙酰半胱氨酸(NAC)處理可提升Nrf2表達,修復抗氧化防御,減少氧化損傷,改善線粒體功能。
意義:靶向氧化還原失衡或可改善CCS長期健康。
研究目的
探究CCS早衰的分子機制,重點驗證氧化應激-抗氧化系統失衡是否為核心驅動因素,并評估NAC干預的潛在治療價值。
研究思路
樣本分組:
實驗組:149例CCS(1-40歲,實體瘤/血液瘤治愈≥1年)。
對照組:70例年齡匹配健康人 + 66例老年人(41-96歲)(詳見表1)。
檢測指標:
線粒體功能(氧化磷酸化效率、ROS產生)。
氧化損傷標志物(脂質、DNA、蛋白質)。
抗氧化分子(NADPH、GSH)及關鍵酶活性/表達。
Nrf2/KEAP1通路調控機制。
干預實驗:NAC處理CCS-MNCs,評估上述指標的可逆性。
統計方法:非參數檢驗(Mann-Whitney U test),GraphPad Prism分析。
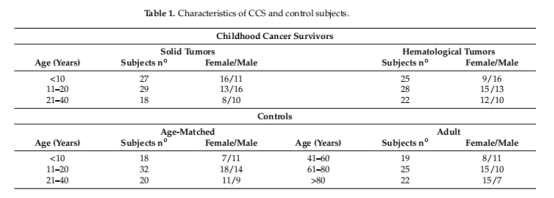
關鍵測量數據及意義(附圖表來源)
1. 線粒體功能障礙與氧化損傷
數據:
P/O比值↓(氧化磷酸化效率):CCS組≈1(健康年輕組≈2.5),與>60歲老人相當(圖1A)。
ROS產生↑:CCS組顯著高于年輕組,達>60歲水平(圖1B)。
氧化損傷累積:MDA、4-HNE(脂質)、8-OHdG(DNA)、硝基酪氨酸(蛋白質)均升高(圖1C-F)。
意義:證實CCS存在能量代謝缺陷和氧化應激累積,與早衰表型直接相關。
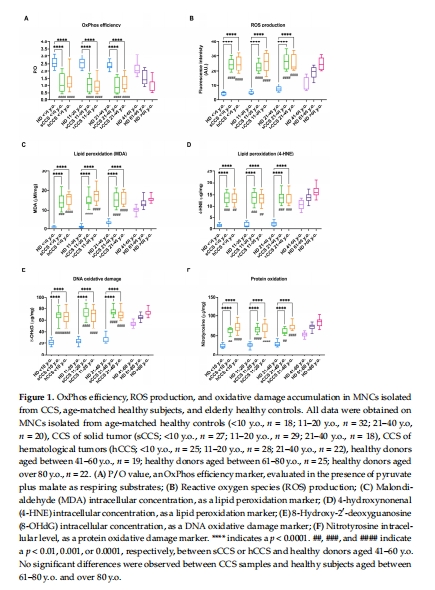
2. 抗氧化防御系統缺陷
數據:
NADPH/NADP↓、GSH/GSSG↓(圖2B, D)。
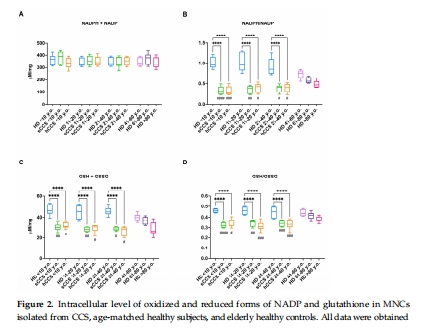
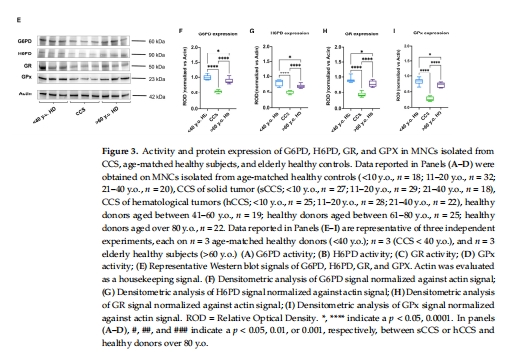
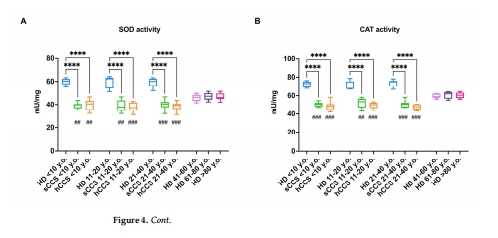
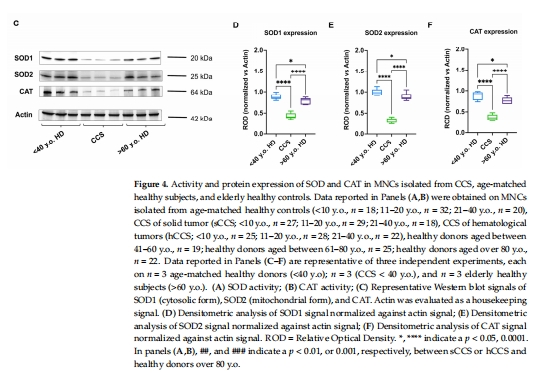
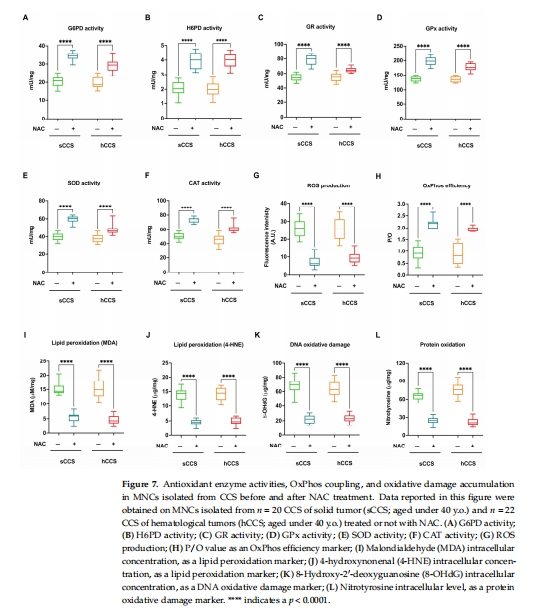
關鍵酶活性↓:G6PD、H6PD(NADPH生成)、GR、GPx(谷胱甘肽代謝)、SOD、CAT(圖3A-D, 圖4A-B)。
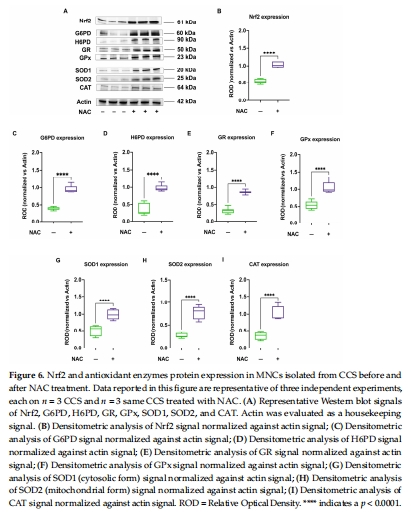
酶表達量↓:Western blot顯示G6PD、H6PD、GR、GPx、SOD1/2、CAT蛋白減少(圖3E-I, 圖4C-F)。
意義:抗氧化能力全面下降,導致氧化損傷無法清除。

3. Nrf2通路失調
數據:
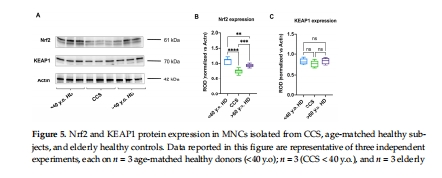
Nrf2蛋白表達↓(圖5A-B),KEAP1無變化(圖5C)。
意義:Nrf2作為抗氧化基因的主調控因子,其下調是抗氧化防御缺陷的核心機制。

4. NAC干預效果
數據:
Nrf2表達↑ → 抗氧化酶表達/活性恢復(圖6, 圖7A-F)。
ROS↓、P/O比值↑、氧化損傷標志物↓(圖7G-L)。
意義:證實靶向Nrf2通路可逆轉CCS的氧化還原失衡。
Unisense電極測量數據的詳細解讀
檢測指標:氧消耗速率(OCR)
方法(2.4節):
使用丹麥Unisense氧電極,在37°C密閉磁力攪拌反應腔中,測量200,000個透化MNCs的實時耗氧量。底物為丙酮酸+蘋果酸(激活線粒體呼吸鏈)。
關鍵結果(圖1A, 圖7H):
CCS組OCR正常,但ATP合成效率低(P/O比值↓),表明呼吸鏈與ATP合成解偶聯。
NAC處理后P/O比值回升,提示線粒體功能修復。
研究意義:
精準量化代謝缺陷:Unisense電極提供高分辨率OCR數據,直接證明CCS線粒體存在解偶聯(電子傳遞未有效轉化為ATP,導致能量浪費和ROS泄漏)。
機制關聯:解偶聯是ROS過度產生的主因(圖1B),為氧化損傷提供源頭證據。
治療驗證:NAC干預后OCR維持但ATP合成效率提升(P/O↑),表明代謝功能可逆,為臨床干預提供依據。
結論
核心機制:CCS早衰與Nrf2下調→抗氧化防御缺陷→氧化損傷累積直接相關,獨立于癌癥類型或治療時間。
線粒體作用:氧化磷酸化解偶聯(Unisense電極證實)是ROS過度產生的關鍵原因。
治療潛力:NAC通過激活Nrf2通路,修復抗氧化防御并改善線粒體功能,或可延緩CCS早衰進程。
臨床意義:靶向氧化還原失衡(如Nrf2激活劑)是改善CCS長期生存質量的新策略。