熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
來源:Nature Communications | (2024) 15:8947
摘要核心內容
創新點:開發了一種氣動微針貼片,利用活體產氣腸桿菌(Enterobacter aerogenes)作為“微生物微引擎”,通過產生氣體主動推動藥物進入深層組織(而非傳統微針的被動擴散)。
關鍵機制:微生物發酵葡萄糖產生氣體(含6.15% H?),形成推進力,使藥物穿透深度增加200%以上(達1000 μm)。
可控性:通過調節葡萄糖濃度精確控制產氣速率與藥物遞送過程。
應用驗證:在銀屑病動物模型中,成功遞送骨化三醇(calcitriol)至皮下組織,顯著緩解癥狀。
研究目的
解決傳統可溶性微針的局限性:
被動擴散不可控:藥物滲透深度受限,難以治療皮膚增厚或深層病變(如銀屑病)。
外部控制不便:現有磁控、光控等技術操作復雜且成本高。
材料產氣缺陷:無機材料產氣量低、持續時間短、殘留物存在安全隱患。
研究思路
微生物選擇:
選用產氣腸桿菌(E.A.),因其能發酵葡萄糖產氣(H?為主),且安全(人體常駐菌)、溫敏范圍廣(15–40°C)。
微針設計:
雙層結構(圖1a, 圖5a):
外層:負載藥物(骨化三醇/羅丹明B)的PVA(聚乙烯醇)。
內層:封裝E.A.和葡萄糖的PEGDA(聚乙二醇二丙烯酸酯)基質。
固化工藝:真空注模+紫外固化(5秒),確保微生物活性(圖3b)。
作用機制:
微針刺入皮膚后,E.A.利用葡萄糖持續產氣 → 氣體壓力推動外層藥物溶解并深入組織(圖1b, 圖6e)。
可控性驗證:通過調節葡萄糖濃度(0–30 mg/mL)調控產氣速率與藥物滲透深度。



關鍵測量數據及研究意義
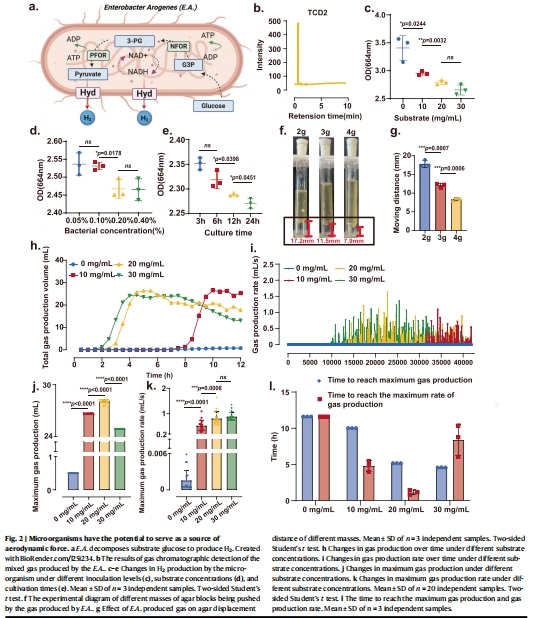
1. 微生物產氣性能(圖2)
數據:
氣相色譜分析:氣體含6.15% H?(圖2b)。
最佳產氣條件:葡萄糖濃度20 mg/mL時,12小時產氣28.7 mL,最大速率1.65 mL/s(圖2h–l)。
推力測試:可推動4g瓊脂塊位移12 mm(最大推力0.04 N)(圖2f,g)。
意義:
證實E.A.可作為高效、可控的“生物微引擎”,為藥物主動遞送提供動力基礎。
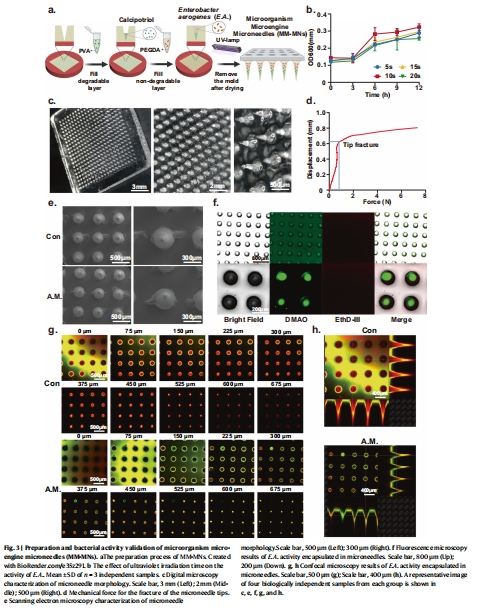
2. 微針制備與微生物活性(圖3)
數據:
UV固化5秒對微生物活性影響極小(圖3b)。
熒光染色(DMAO/EthD-III)顯示 >95%微生物存活(圖3f–h)。
微針機械強度(穿刺力≈0.6N)滿足透皮需求(圖3d)。
意義:
驗證微針制備工藝可行性及微生物在固化后仍保持活性,確保持續產氣能力。
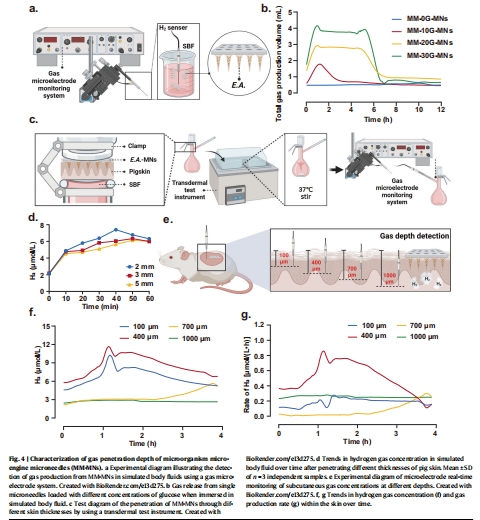
3. 氣體滲透深度(圖4)
數據(使用丹麥Unisense微電極系統):
皮下H?濃度監測(圖4e–g):
在100–1000 μm深度實時檢測H?濃度變化。
氣體可穿透5 mm厚豬皮,且在深層組織(>500 μm)持續存在(圖4d)。
產氣速率峰值出現在接種后5–6小時(與藥物擴散延遲1–2小時相關)(圖6d)。
Unisense電極數據的核心意義:
直接證明氣體在組織中的動態擴散:通過原位監測H?濃度,量化氣體穿透深度(達1000 μm),為“氣體推動藥物”機制提供實驗依據。
關聯藥物遞送控制:氣體濃度變化曲線(圖4f,g)與藥物擴散深度(圖5e, 圖6b,c)高度相關,證實通過葡萄糖濃度可編程控制遞送過程。
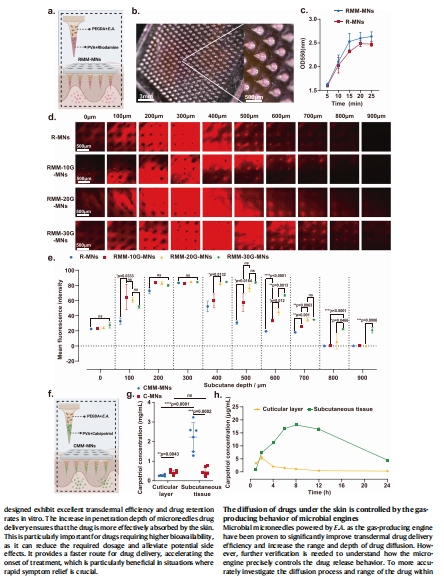
4. 藥物遞送性能(圖5)
數據:
羅丹明B釋放實驗:微生物微針(RMM-MNs)釋放速率顯著高于傳統微針(R-MNs)(圖5c)。
豬皮滲透深度:30 mg/mL葡萄糖組達900 μm(傳統微針<400 μm)(圖5d,e)。
動物實驗:CMM-MNs組皮下骨化三醇濃度顯著高于對照組(圖5g,h)。
意義:
微生物微針將藥物遞送深度提升至傳統微針的2倍以上,突破擴散限制。
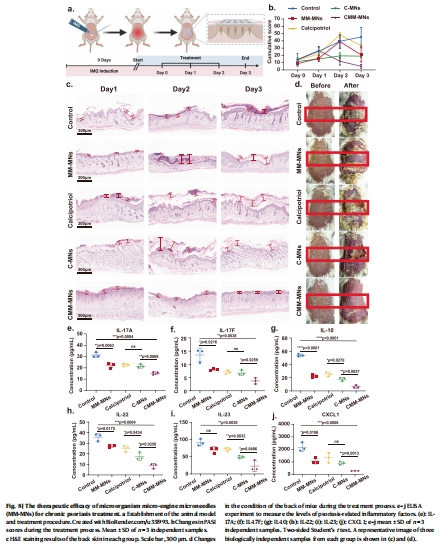
5. 銀屑病治療療效(圖7,8)
數據:
PASI評分:CMM-MNs組癥狀改善最快(圖7b)。
炎癥因子(IL-17A/F, IL-22等):CMM-MNs組顯著低于對照組(圖7c–h, 圖8e–j)。
意外發現:單獨微生物微針(MM-MNs)通過H?抗炎作用減輕癥狀(圖7c–i)。
意義:
證實技術對深層炎癥疾病的有效性,且H?協同增強抗炎效果。

核心結論
成功開發活微生物微針系統:
微生物在微針內保持活性,通過發酵葡萄糖持續產氣(H?為主),形成可控推進力(0.04 N)。
突破藥物遞送深度限制:
藥物穿透深度達1000 μm(傳統微針的200%以上),且通過葡萄糖濃度精準調控。
治療銀屑病高效:
在動物模型中顯著改善癥狀(PASI評分↓,炎癥因子↓),并發現H?的輔助抗炎作用。
安全性:
微生物被限制在PEGDA基質內,不接觸組織;無顯著肝/腎毒性(附圖S20)。
研究價值與展望
創新性:首次將活微生物作為“生物微引擎”整合至微針,實現主動可控的藥物遞送。
應用潛力:適用于需深層給藥的疾病(如銀屑病、腫瘤),并為蛋白/細胞療法遞送提供新思路。
未來方向:
探索不同微生物(產H?S/NO等治療性氣體)。
結合微環境響應設計(如葡萄糖濃度反饋調控胰島素釋放)。
建立氣體-藥物擴散的數學模型優化設計。
總結:該研究通過巧妙的“微生物微引擎”設計,解決了微針藥物遞送深度不足的關鍵問題,為可控透皮給藥提供了突破性方案,兼具創新性、可控性與治療有效性。