熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Radiotherapy activates picolinium prodrugs in tumours
2024-放療在腫瘤中激活 picolinium 前藥
來源:Nature Chemistry(2024),doi:10.1038/s41557-024-01501-4
1.摘要核心內容
本文提出了一種基于放療激活的吡啶鎓前藥(NAP)系統,通過結合光誘導電子轉移(PET)化學與放療技術,開發了一種新型的輻射可移除保護基團。該保護基團(NAP)在放療產生的水合電子(e?aq)作用下高效釋放功能分子(如熒光染料或毒素),并成功應用于抗體藥物偶聯物(ADC)。實驗表明,NAP在放療下的釋放效率優于現有保護基團,且設計的ADC在細胞和荷瘤小鼠中展現出顯著的抗腫瘤效果,為下一代ADC的開發提供了新思路。
研究目的
核心目標:開發一種高效、廣譜的放療激活前藥策略,解決現有放療激活前藥效率低、化學選擇性差的問題。
科學問題:如何利用放療誘導的水合電子(e?aq)實現腫瘤內藥物的精準釋放,并驗證其在ADC中的應用潛力?
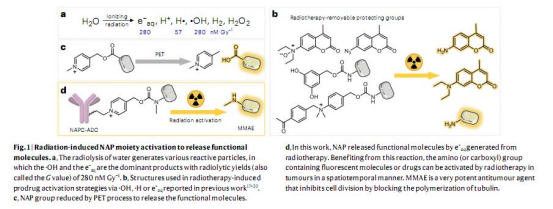
研究思路
1. 保護基篩選:通過合成不同取代位點和電荷的吡啶衍生物(化合物1-9),篩選出對e?aq響應最敏感的N-烷基-4-吡啶鎓(NAP)(圖2)。
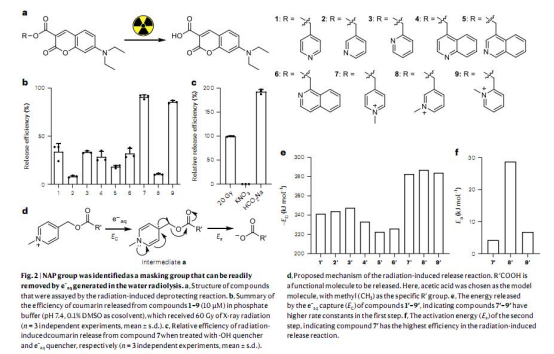
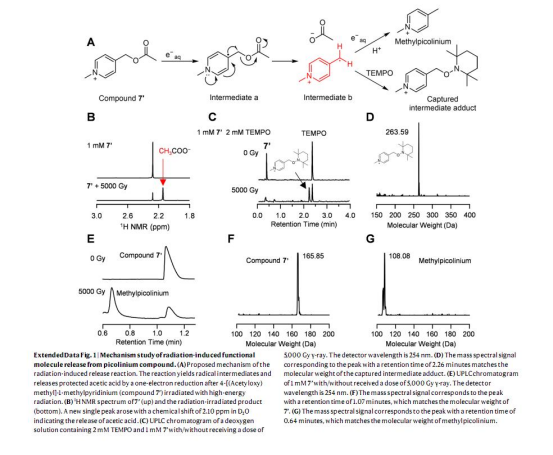
2. 機制驗證:結合理論計算和實驗(如自由基捕獲、UPLC-MS分析),揭示NAP通過捕獲e?aq觸發C-O鍵斷裂釋放功能分子的機制(圖2e-f,Extended Data Fig.1)。
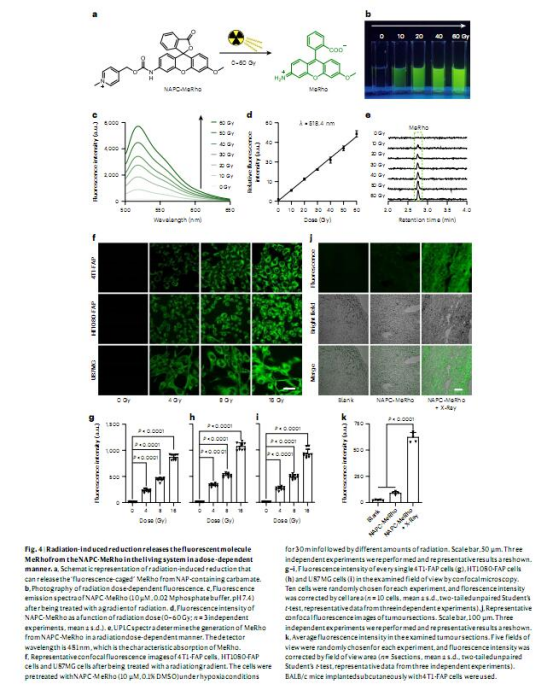
3.應用開發:
熒光探針驗證:設計NAPC-AMC和NAPC-MeRho探針,驗證其在細胞和腫瘤中的放療激活釋放(圖3-4)。
ADC構建:將NAP保護基整合到靶向FAP的ADC中(sibrotuzumab-NAPC-MMAE),通過放療激活釋放毒素MMAE(圖5-6)。
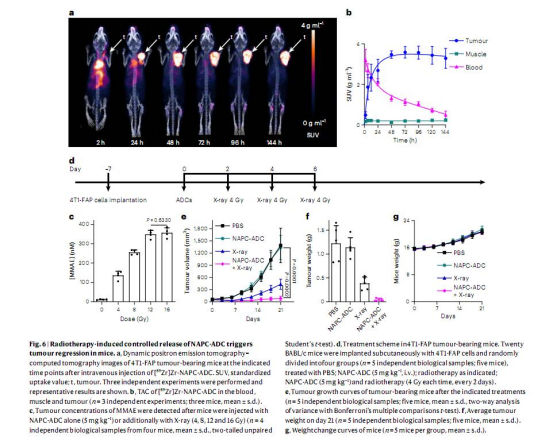
4. 體內外驗證:通過細胞毒性實驗、荷瘤小鼠模型和PET成像,評估ADC的穩定性、藥物釋放效率和抗腫瘤效果(圖5-6)。
測量數據及意義

結論
1.NAP的高效性:NAP保護基通過捕獲e?aq實現高效藥物釋放,其釋放效率(G值137 nM Gy?1)接近理論極限,優于現有保護基。
2.ADC應用成功:設計的NAPC-ADC在荷瘤小鼠中實現MMAE的精準釋放,顯著抑制腫瘤生長且無顯著毒性。
3.臨床潛力:該策略為開發放療激活的下一代ADC提供了化學基礎,尤其適用于難切除腫瘤的聯合治療。
Unisense電極數據的意義
實驗條件驗證:
Unisense OX-50電極用于實時監測細胞和腫瘤微環境中的氧濃度,確認實驗在缺氧條件(1%O?)下進行,模擬實體瘤的生理環境(Methods部分)。
研究意義:
1.機制驗證:缺氧環境減少氧自由基干擾,確保e?aq主導NAP的還原反應,支持放療激活的化學機制。
2.臨床相關性:實體瘤普遍缺氧,Unisense數據證明該策略在真實腫瘤微環境中的可行性,增強轉化潛力。