熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
3.3. 生物電極形態和微環境表征
3.3.1. 生物電極形態

圖3. (a)空白玻璃纖維、(b)未通電生物陰極和(c)未通電生物陽極的SEM圖像,以及(d)電刺激后生物陰極和(e)電刺激后生物陽極的SEM圖像。
電極上的生物膜在產電細菌與電極之間的物理接觸或其他使用電子轉移的電子通信中起重要作用。使用SEM表征生物陽極和生物陰極上生物膜的形態。如圖3a所示,未培養GF有大量微單絲交織在一起,表面光滑清潔。GF的互連結構可能促進電子傳輸并為微生物生長提供豐富空間。運行約一個月后,GF表面被稀疏和分散的生物膜覆蓋(圖3b和c),表明GF上成功形成生物膜。與開路條件相比,電刺激后陽極和陰極上的生物膜呈現致密、剛性和簇狀外觀(圖3d和e)。由微球菌和桿狀細菌組成的生物膜覆蓋陰極,較薄;一些細菌鏈狀生長。觀察到當培養電壓在1.0和2.5 V之間時電刺激對細胞生長的影響。值得注意的是,生物陽極上形成多層結構生物膜,而生物陰極上觀察到不均勻結構生物膜。可能解釋是吡啶廢水首先通過陽極區然后通過陰極區。因此,吡啶降解可能集中在陽極室。吡啶傾向于在生物電化學系統的陽極室生物降解。此外,從微生物生態學角度看,封閉在生物膜中的微生物由于相對穩定的環境,對有毒物質和環境波動有更好抵抗力。此外,生物膜作為內部細菌對抗化學物質的保護屏障。陽極上較厚的生物膜改善生物質保留,特別是對于慢速生長物種;因此可以建立更平衡的微生物群落,有利于高效處理復雜吡啶廢水。
3.3.2. 生物陽極微環境
陽極在厭氧系統中的作用不僅作為替代終端電子受體,也是產氧場所,導致陽極周圍微環境變化。使用微電極測量進行生物陽極中氧濃度和pH變化測試。如圖4所示,本體溶液中氧濃度始終低于0.05毫克/升,表明反應器中嚴格厭氧條件。當生物陽極深度從0到1500微米時,氧濃度快速從0.03增加至0.23毫克/升。氧分布表明生物陽極內部,即近陽極表面,產生氧氣,在陽極區創造更缺氧條件。向陽極引入氧氣有益于頑固有機物降解。適當量的氧氣可刺激細菌生長或幫助底物利用范圍擴展。然而,應注意,當生物陽極深度從1500到2000微米時,氧濃度快速從0.23降低至0.15毫克/升。推測氧濃度下降是由于生物膜內好氧和兼性細菌代謝消耗。pH值分布趨勢與氧濃度相似。由于合成廢水中磷酸鹽緩沖液,本體溶液pH穩定在7.35-7.51。然而,pH值從生物陽極表面的7.36增加至1600微米深度處的7.81,這可能源于吡啶生物礦化過程中NH4-N釋放。當生物陽極深度達到2000微米時,pH值回到7.35,這可能源于兩個原因。首先,陽極產生氧氣時,同時產生一部分質子。其次,推測堿性氨通過生物氨去除過程被去除,導致pH降低。此過程也可能消耗生物陽極中的氧氣,假定為1500-2000微米深度氧濃度下降的另一原因。
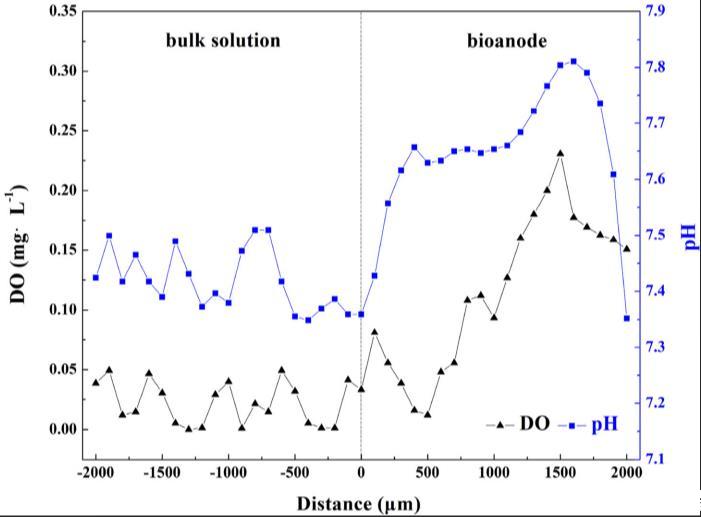
圖4. 生物陽極中氧氣濃度與pH值的變化曲線
3.4. 微生物群落結構分析
采用Illumina高通量測序16S rRNA基因分析系統中微生物群落的豐度和多樣性。如表S2所示,通過引物和條形碼匹配原始讀數和一系列過濾過程,獲得總有效序列標簽數35381(S0)、28578(S1)、35147(S2)、33946(S3)和33847(S4)。S3和S4的OTU數(487和497)遠低于S1和S2(554和609),對應更低Chao1值、ACE值和Shannon指數。這些結果顯示電刺激可能降低微生物群落多樣性和豐度,表明對電刺激敏感的細菌群落代謝可能被抑制。此外,S1和S3的OTU數(554和487)遠低于S2和S4(609和497),對應更低Chao1值、ACE值和Shannon指數,表明電輔助厭氧系統陽極中微生物群落多樣性較少。這可能歸因于更高濃度吡啶首先接觸生物陽極,導致由于吡啶毒性,陽極生物膜上細菌多樣性較少。此結果與先前觀察到的陽極上較厚生物膜一致。
如圖5a所示,門水平群落結構分析顯示酸桿菌門、綠彎菌門、廣古菌門、硝化螺旋菌門和浮霉菌門在這些樣品中占主導。擬桿菌門(36.62%和36.00%)和疣微菌門(14.35%和13.63%)在S1和S2生物膜中占主導,而在S3和S4生物膜中,綠菌門(23.95%和18.79%)和變形菌門(41.76%和48.34%)是主導細菌門。比較分析發現,電刺激前生物膜(S0)中的主導細菌擬桿菌門的豐度分別降至8.65%(S3)和7.24%(S4)。

圖5. 不同階段微生物按(a)門類和(b)屬級分類分布
疣微菌門顯示出類似趨勢。這些結果表明擬桿菌門和疣微菌門的生長被施加的電流抑制。此外,綠菌門和變形菌門的相對豐度高于S1和S2中的,表明電刺激選擇性富集了特定物種。
選擇每個樣品中16個最豐富的屬進行屬水平細菌群落的進一步分析。如圖5b所示,S1和S2中有四個屬含量豐富,包括脫氯單胞菌屬(4.76%和8.96%)、甲基過飽和菌屬(16.43%和16.98%)、泥桿菌屬(9.24%和7.78%)和褐螺菌屬(18.4。泥桿菌屬可能在缺氧條件下吡啶生物降解和反硝化中起重要作用(。褐螺菌屬在生物電化學系統中的作用在撰寫本文時仍未知。據推測,這四個屬的代謝可能被電刺激抑制。此外,在S3和S4中,脫硫弧菌屬(4.50%和5.66%)、獨島桿菌屬(15.43%和14.64%)、嗜氫菌屬(9.45%和7.54%)和副球菌屬(11.36%和10.33%)的豐度高于S1和S2中的。脫硫弧菌屬是一種通常厭氧生長的細菌,已知主要負責氧化性污染物的還原轉化修復(。獨島桿菌屬以其降解芳香烴的能力而聞名。據報道,嗜氫菌屬通過使用純培養或混合細菌培養將揮發性脂肪酸轉化為芳香烴的可能性。根據先前報告,副球菌屬是一種反硝化細菌,也是一種優秀的吡啶降解菌。以上結果表明施加的電流可能有利于這些吡啶降解細菌物種的富集。有趣的是,在同一時期,生物陽極和生物陰極之間的微生物群落結構中的細菌物種沒有顯著差異,這與我們之前的研究相似。然而,本研究中發現某些特定物種的物種豐度存在差異。蛭弧菌屬和獨島桿菌屬的豐度(7.32%和15.43%)略高于S4中的(6.33%和14.64%)。蛭弧菌屬和獨島桿菌屬通常發現于好氧生物系統,因此推測細菌豐度的細微差別是由于陽極上氧氣的產生。結果,通過陽極群落的互養相互作用,電輔助厭氧系統中吡啶去除取得了巨大改進。
3.5. 研究意義
總體而言,施加的電流將有利于厭氧系統中吡啶的降解。也有報道稱類似的作用,即電化學刺激可以增強洛克沙胂生物降解和礦化為無機砷。當施加直流電時,陽極上形成致密的生物膜,這將更好地抵抗有毒吡啶和環境波動。這一結果可能揭示電生物系統在遭受高吡啶負荷時可能更具耐受性。此外,電化學刺激以及生物陽極中的微好氧環境可能有利于一些吡啶降解細菌物種和反硝化細菌物種的富集。因此,通過陽極群落的互養相互作用,吡啶的生物降解和礦化顯著增強。吡啶環可能在N和C-2原子之間裂解,隨后脫氨基形成戊二醛,然后連續氧化成戊二酸半醛,導致琥珀酸和甲酸作為最終產物。不幸的是,在本研究中未能成功鑒定吡啶降解過程中的具體中間體,這需要進一步研究。
經濟可行性是將該技術從實驗室規模推向大規模實際應用的重要問題。簡單的配置和低的運營成本對于電輔助厭氧反應器大規模成功應用至關重要。商業化可擴展電輔助厭氧反應器的主要挑戰包括開發有效且低成本的電極材料以及降低能耗。在本研究中,通過將一對石墨氈耦合到厭氧反應器中開發了電生物反應器。簡單的配置便于現有厭氧系統的升級。此外,使用更便宜的材料,即碳顆粒、碳纖維刷和石墨氈,將進一步降低資本成本。根據在線提供的石墨氈價格,厭氧系統升級的額外材料成本低于250美元/立方米,這使其適用于大規模實際應用。另一方面,當吡啶濃度為500毫克/升且HRT為36小時時,所提出系統中的最大吡啶去除率高于3.6摩爾/立方米·天。然而,當吡啶濃度為100毫克/升且HRT為72小時時,對照厭氧系統中的最大吡啶去除率僅為0.4摩爾/立方米·天。施加0.3毫安直流電后,厭氧反應器的吡啶生物降解性能顯著提高。同時,該系統中估計的能耗低于0.0046千瓦時/摩爾吡啶,但根據我們之前的工作,純電化學系統中約為96.3千瓦時/摩爾吡啶,表明運營成本顯著降低。這一發現證明電刺激厭氧系統具有成為一種經濟有效的技術,用于高效處理高濃度吡啶廢水的巨大潛力。
4. 結論
本研究中,在電流刺激下的厭氧反應器中實現了吡啶的穩定和增強的生物礦化。當提供電流時,厭氧反應器抵抗環境應力(如高吡啶濃度、短HRT和低乙酸鈉投加量)的能力得到加強。由于電刺激,形成的致密生物膜以及生物陽極中的微好氧環境促進了吡啶的降解。此外,與吡啶生物降解相關的功能物種在電流供應下也在厭氧系統中富集,這可能是性能改善的主要原因之一。本研究表明,電輔助厭氧反應器將是處理含吡啶廢水的一種有前景的替代方案。
 相關新聞
相關新聞