熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
研究簡介:腫瘤微環(huán)境(TME)在腫瘤進展中發(fā)揮重要作用,其中CAFs表現(xiàn)出多種促腫瘤效應,能夠誘導腫瘤免疫逃逸和藥物耐受性。CAFs通過分泌細胞因子和趨化因子(如TGF-β、IL-6等)抑制T細胞反應,招募免疫抑制細胞,從而形成免疫抑制性微環(huán)境。因此,調(diào)節(jié)CAFs的表型可能成為增強系統(tǒng)性抗腫瘤免疫的潛在策略。研究人員首先通過體外實驗觀察氫氣對CAFs的影響,發(fā)現(xiàn)氫氣能夠減輕CAFs內(nèi)的活性氧(ROS)水平,下調(diào)一氧化氮合酶(Nos2)的表達,并逆轉(zhuǎn)CAFs的促腫瘤和免疫抑制表型。基于此,研究團隊開發(fā)了Mg-CaCO?系統(tǒng),利用其在弱酸性TME中快速穩(wěn)定的氫氣釋放能力,實現(xiàn)對CAFs的調(diào)節(jié)。
實驗中,研究團隊制備了Mg-CaCO?棒,并通過掃描電子顯微鏡(SEM)、能量色散X射線光譜(EDS)和X射線衍射(XRD)等技術(shù)對其進行了表征。結(jié)果顯示,Mg-CaCO?棒在pH 6.8的弱酸性環(huán)境中氫氣釋放量顯著增加,表現(xiàn)出良好的pH響應性。在體外實驗中,Mg-CaCO?顯著抑制了4T1腫瘤細胞的活性,并誘導細胞凋亡。其機制是通過破壞線粒體膜電位(MMP)和擾亂細胞內(nèi)氧化還原平衡來實現(xiàn)的。此外,Mg-CaCO?處理的CAFs顯示出較低的ROS水平和Nos2表達,多種CAFs標志物(如Fn1、Col1a1、Vim等)和促腫瘤因子(如Mmp2、Il-6)的表達也顯著下調(diào)。
特別是Cxcl1和Cxcl12的表達被抑制,這兩種因子與CD4?T細胞的免疫抑制表型相關(guān)。在與CD4?T細胞的共培養(yǎng)模型中,Mg-CaCO?處理的CAFs顯著降低了Foxp3的表達和Treg比例,同時增強了免疫激活標志物的表達。在體內(nèi)實驗中,研究團隊通過超聲成像技術(shù)監(jiān)測了Mg-CaCO?在腫瘤內(nèi)的氫氣生成能力,并通過電感耦合等離子體質(zhì)譜(ICP-MS)檢測了降解產(chǎn)物。結(jié)果顯示,Mg-CaCO?在腫瘤內(nèi)具有高效穩(wěn)定的氫氣生成能力,且降解產(chǎn)物不會影響全身的鈣和鎂平衡。在Balb/c裸鼠和免疫健全的Balb/c小鼠中,Mg-CaCO?顯著抑制了4T1腫瘤的生長,并通過重塑CAFs表型促進了CD4?T細胞的浸潤。
Unisense氫電極應用
使用Unisense氫電極來檢測Mg、Mg-CaCO?和Mg-OPSZ棒在不同pH值的磷酸鹽緩沖溶液(PBS)中氫氣的生成情況。實驗分別在pH 7.4(生理條件)和pH 6.8(模擬腫瘤微環(huán)境的弱酸性條件)下進行。氫微電極在超純水中極化過夜,極化電壓為1000 mV。當電壓降至50 mV以下時,電極被插入到一定體積的PBS溶液中。隨后將Mg、Mg-CaCO?或Mg-OPSZ棒加入PBS溶液中,氫氣的生成量每10秒記錄一次。通過實時監(jiān)測氫氣的生成速率和總量,從而評估不同材料在不同環(huán)境條件下的氫氣釋放能力。
實驗結(jié)論
本研究發(fā)現(xiàn)氫氣可逆轉(zhuǎn)癌癥相關(guān)成纖維細胞(CAFs)的免疫抑制表型,并基于此開發(fā)了一種腫瘤微環(huán)境(TME)響應的Mg-CaCO?氫治療系統(tǒng)。該系統(tǒng)不僅能直接殺傷腫瘤細胞,還能通過下調(diào)CAFs中促腫瘤和免疫抑制因子(如Nos2、Cxcl1、Cxcl12等),重塑腫瘤基質(zhì)微環(huán)境,增強CD4?和CD8?T細胞的浸潤與活性,將“冷腫瘤”轉(zhuǎn)化為“熱腫瘤”,從而激活系統(tǒng)性抗腫瘤免疫反應。在多種小鼠腫瘤模型中,Mg-CaCO?氫療法顯著抑制了原發(fā)瘤和遠端瘤的生長,提升了血清中免疫激活因子(如IFN-γ、TNF-α)水平,并與免疫檢查點抑制劑(αPD1)聯(lián)用展現(xiàn)出協(xié)同抗腫瘤效應,顯著延長小鼠生存期。Mg-CaCO?氫療法通過重塑CAFs表型和腫瘤免疫微環(huán)境,為治療免疫排斥型“冷腫瘤”提供了一種安全、有效且具備臨床轉(zhuǎn)化潛力的新策略。
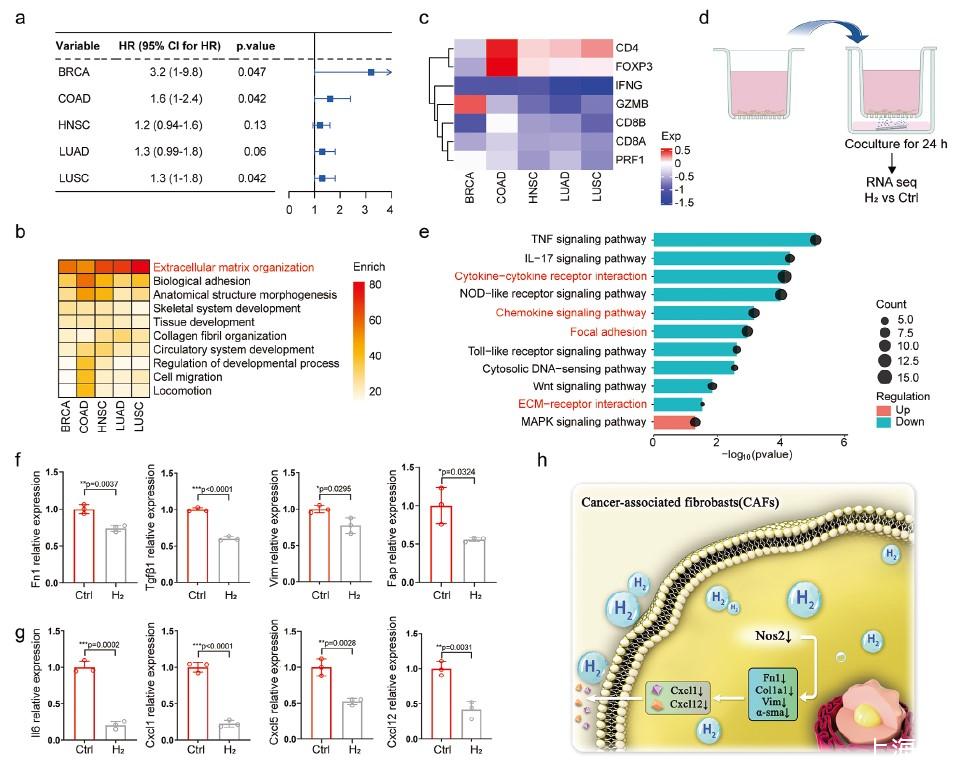
圖1、泛癌CAFs的畫像及氫處理反轉(zhuǎn)CAF表型。a)不同TCGA數(shù)據(jù)集中高低CAF特征表達組的總體生存率(OS)。b)熱圖顯示不同TCGA數(shù)據(jù)集中CAF高組上調(diào)基因的富集通路。c)熱圖顯示不同TCGA數(shù)據(jù)集中CAF高組和低CAF組的關(guān)鍵免疫基因表達折疊變化。d)使用transwell體外氫處理模型示意圖。e)條形圖顯示H組DEGs通路富集,與Ctrl組相比。f,g)通過qPCR分析CAFs中CAF中CAF的MRNA水平,包括(H)或未(Ctrl)氫處理(n=3)。h)CAF表型逆轉(zhuǎn)氫處理機制的示意圖示。
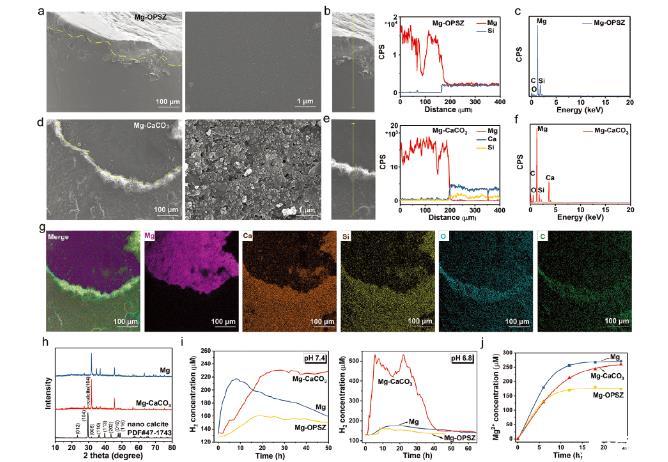
圖2、Mg-CaCO3棒的制備與表征。a-d)a)Mg-Opsz棒和b)Mg-CaCO3棒的代表性SEM圖像。比例條:100和1微米,如所示。b,e)局部SEM圖像及(b)Mg-Opsz棒和e)Mg-CaCO3rods中元素的對應分布。c-f)c)Mg-OPSZ棒和f)Mg-CaCO3rods的EDS光譜。g)制備后Mg-CaCO3rods的STEM圖像,顯示Mg、Ca、Si、O和C的元素分布。比例條=100微米。(h)Mg棒、Mg-CaCO棒和納米方解石的XRD圖譜。i)通過氫電極測量PBS中Mg、Mg-OPSZ或Mg-CaCO棒(pH 7.4和pH 6.8)的氫生成。j)通過ICP-MS測量PBS溶液中Mg、Mg-OPSZ或Mg-CaCO3棒的Mg釋放曲線。
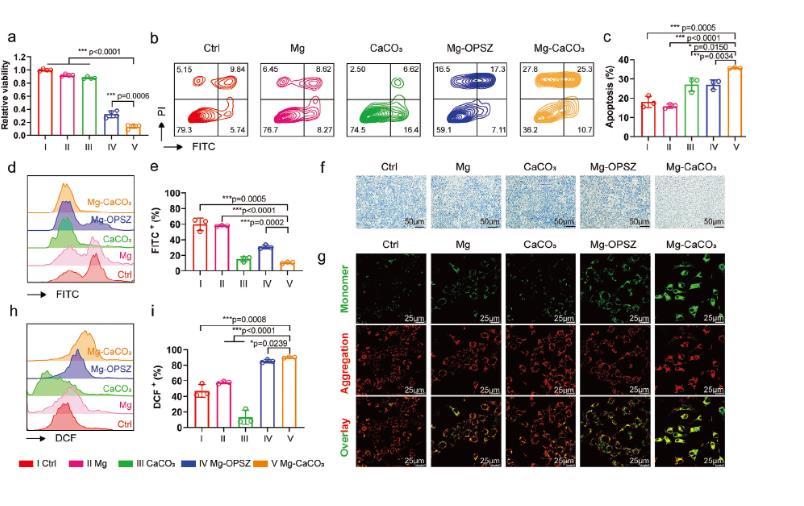
圖3、Mg-CaCO3抗腫瘤效果的體外評估。a)4T1細胞在24小時內(nèi)的相對細胞存活率(n=4)。b,c)流式細胞術(shù)分析(b)及相應定量分析(c)通過Annexin V/PI染色4T1細胞凋亡范圍(n=3)。d,e)流式細胞術(shù)測定(d)及BCECF AM探針對4T1細胞pH水平的定量分析(n=3)。f)MB染色4T1細胞氫生成的定性分析。比例桿=50微米。g)對4T1細胞進行不同處理后的熒光顯微鏡圖像,然后用JC-1染料染色。比例桿=25微米。h,i)通過DCFH-DA探針對4T1細胞細胞內(nèi)ROS水平(DCF細胞比率)進行流式細胞術(shù)分析(h)及相應定量分析(i)(n=3)。組別:I組:Ctrl,II:Mg,III:CaCO,IV:Mg-OPSZ,V:Mg-CaCO。統(tǒng)計顯著性通過雙尾學生t檢驗計算。p<0.05,p<0.01,p<0.001。顯示平均值和標準差。
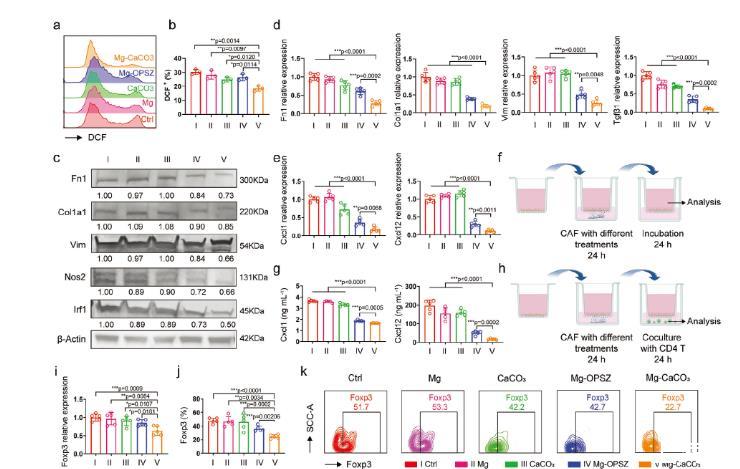
圖4、Mg-CaCO3的CAF重塑和免疫調(diào)節(jié)作用的體外評估。a,b)流式細胞術(shù)測定(a)和相應的定量分析(b)不同處理的CAF中細胞內(nèi)ROS水平(DCF細胞比率)(n=3)。c)不同處理的CAFs的CAF標記蛋白的Western blot分析。d)通過qPCR分析不同處理的CAF中CAF標志物的MRNA水平(n=5)。e)通過qPCR分析不同處理的CAF中Cxcl1和Cxcl12的mRNA水平(n=5)。f,h)使用transwell的體外共培養(yǎng)模型示意圖f)不帶和h)與CD4T細胞(用bioRender.com創(chuàng)建)。g)不同處理的CAF上清液中Cxcl1和Cxcl12水平的濃度定量(n=5)。i)通過qPCR分析與不同處理的CAF共培養(yǎng)的CD4T細胞中Foxp3的MRNA水平(n=5)。j,k)流式細胞術(shù)測定(k)和與不同處理的CAF共培養(yǎng)的CD4T細胞中Treg(Foxp3cell)的相應定量分析(j)(n=5)。組:I:Ctrl,II:Mg,III:CaCO3,IV:Mg-OPSZ,V:Mg-CaCO3。
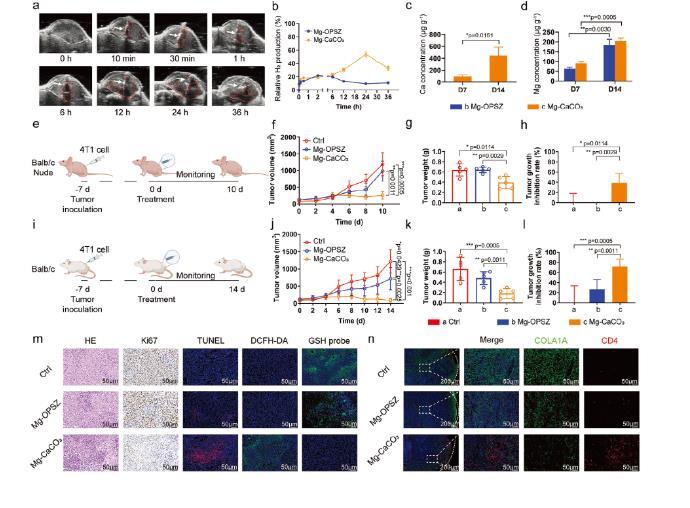
圖5、Mg-CaCO3的體內(nèi)抗腫瘤和TME重塑作用。a)用Mg-OPSZ和Mg-CaCO3棒瘤內(nèi)給藥后對4T1荷瘤小鼠進行體內(nèi)時間依賴性超聲成像。b)基于超聲成像數(shù)據(jù)對信號強度進行定量分析。c,d)不同治療7天和14天后小鼠腫瘤中的Ca(c)和Mg(d)水平(n=3)。e,i)Balb/c裸體(e)和Balb/c(i)小鼠皮下4T1小鼠腫瘤模型示意圖。f-h)不同處理后Balb/c裸鼠的腫瘤生長曲線(f),腫瘤重量(g)和腫瘤抑制率(h)(n=5)。j-l)不同處理后Balb/c裸鼠的腫瘤生長曲線(j),腫瘤重量(k)和腫瘤抑制率(l)(n=5)。m)不同處理后從Balb/c小鼠采集的腫瘤的H&E,Ki67,TUNEL,DCFH-DA和GSH探針染色的顯微鏡圖像。比例尺=50μm。n)不同治療后從Balb/c小鼠收集的腫瘤的IF圖像。綠色:COL1A1,紅色:CD4,藍色:DAPI,比例尺:200和50μm,如圖所示。
結(jié)論與展望
腫瘤微環(huán)境(TME)在腫瘤進展中起著重要作用。在TME成分中,癌相關(guān)成纖維細胞(CAFs)具有多種促進腫瘤的效應,并可誘導腫瘤免疫逃避和藥物耐藥性。調(diào)控CAFs可作為增強全身抗腫瘤免疫的潛在策略。研究觀察到氫處理可緩解CAFs細胞內(nèi)活性氧,重塑CAFs的腫瘤促進和免疫抑制表型。因此基于CaCO納米顆粒涂層鎂系統(tǒng)(Mg-CaCO3)開發(fā)出可控且對TME有反應的氫治療。
Mg-CaCO3的氫治療不僅能直接殺死腫瘤細胞,還能抑制CAFs中的促腫瘤和免疫抑制因子,從而增強CD4T細胞的免疫活性。原位植入時,Mg-CaCO3可顯著抑制腫瘤生長,將“冷”原發(fā)腫瘤轉(zhuǎn)變?yōu)椤盁帷蹦[瘤,并刺激系統(tǒng)性抗腫瘤免疫,由雙側(cè)腫瘤移植模型中“冷腫瘤”(4T1細胞)和“熱腫瘤”(MC38細胞)得到證實。
該氫治療系統(tǒng)逆轉(zhuǎn)CAFs的免疫抑制表型,通過重塑腫瘤基質(zhì)微環(huán)境,提供系統(tǒng)性的抗腫瘤免疫刺激策略。Unisense微型氫電極通過高精度的氫氣檢測,為研究提供了氫氣生成速率和總量的定量數(shù)據(jù)。通過長時間監(jiān)測,證明了Mg-CaCO?棒在體內(nèi)能夠持續(xù)穩(wěn)定地釋放氫氣,為氫療法的臨床應用提供了重要依據(jù)。與超聲成像技術(shù)結(jié)合,全面評估了氫療法在體內(nèi)的效果,為后續(xù)的抗腫瘤實驗提供了有力支持。本研究證明了氫療法通過Mg-CaCO?系統(tǒng)能夠有效逆轉(zhuǎn)CAFs的免疫抑制表型,重塑腫瘤基質(zhì)微環(huán)境,并激活系統(tǒng)性抗腫瘤免疫反應。這種療法不僅直接殺傷腫瘤細胞,還能通過調(diào)節(jié)CAFs增強免疫細胞的浸潤和活性,為腫瘤治療提供了一種新的策略。
 相關(guān)新聞
相關(guān)新聞