熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
鈣藻酸鹽珠內生物量分布分析
鈣藻酸鹽珠內生物量分布分析按所述方法進行。珠內生物量濃度測定通過將藻酸鹽珠溶解在1%檸檬酸鈉溶液中實現。定期收集液相并用新鮮檸檬酸鈉溶液替換。細胞密度如上所述測定。在此分析前后珠尺寸用卡尺測量,在氯化鈉和氯化鈣溶液中孵育5小時后。每種類型50個珠被測量以獲得足夠準確性。
藻酸鹽珠內pH梯度測量
包含固定化L.lactis亞種lactis的藻酸鹽珠從反應器中取樣,并立即置于包含從反應器流出物獲得的介質的腔室中。流出物離心以去除自由細胞,介質pH在這些測量前控制。測量腔室溫度通過循環介質通過恒溫水浴控制在30°C,使用蠕動泵。此再循環環還提供劇烈攪拌以最小化外部質量傳遞限制。測量使用pH微電極進行,連接到手動微操縱器。微操縱器提供連續橫向移動定位,最小校準單位相當于20μm,尖端在立體顯微鏡觀察下定位。參考電極置于周圍介質中。使用的pH電極尖端直徑為15μm。pH微電極在三個不同pH值校準,測量的mV響應與pH的關系通過線性回歸建立。
乳酸濃度測定
乳酸濃度在發酵期間間隔測定。樣品加入冷高氯酸中,離心并通過0.2-μm注射器過濾器過濾后進行HPLC分析。使用色譜儀,配備自動進樣器,使用Aminex HPX-87-H柱在45°C和RI檢測器。作為洗脫液,使用5 mmol l?1H?SO?。商業標準用于校準。
結果
藻酸鹽珠中包含乳酸乳球菌亞種lactis的生物量和活性分布
固定化細菌從鈣藻酸鹽珠的釋放與細菌在珠中的生長相關。隨著細菌生長,珠中生物量分布發生變化。為了研究這些變化,包含固定化L.lactis亞種lactis NCIMB 6681的珠在控制pH 6.5下連續發酵,并在不同發酵時間收獲進行生物量分布分析。珠在開始和連續發酵5.5、12和48小時后的生物量分布如圖1所示。
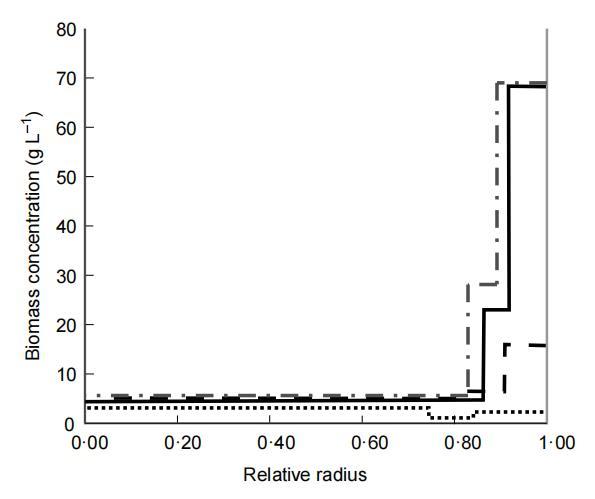
最初,珠包含均勻分布的生物量。在連續發酵的前12小時內,生物量分布發生變化,因為珠最外層的生物量濃度比珠中心增加更多。發酵12小時后,珠最外層約150μm厚的層包含約73%的生物量。生物量濃度似乎不隨發酵延長在此層進一步增加。在連續發酵48小時后分析的珠中,約73%的生物量位于珠最外層180μm內。然而,在珠較深層也觀察到生物量濃度的輕微增加。在珠中心,生物量濃度在5.5至48小時發酵期間未觀察到變化。
生物量的代謝活性及其在珠內的分布通過監測乳酸生產速率進行研究。使用直徑在1.4至3.5 mm之間的各種珠以研究珠尺寸對乳酸生產速率的影響。這些珠在pH 6.5下連續發酵48小時。在初始增加后,乳酸生產速率穩定。穩定后的乳酸生產速率如圖2所示,并表示為每種珠尺寸的乳酸生產速率與3.3 mm珠的乳酸生產速率的比值。每個速率基于總珠體積和總珠表面積呈現。較小直徑的珠似乎具有比較大的直徑珠更大的體積基準乳酸生產速率。記錄的1.4 mm珠的體積基準乳酸生產速率比3.3 mm珠觀察到的速率大90%以上。
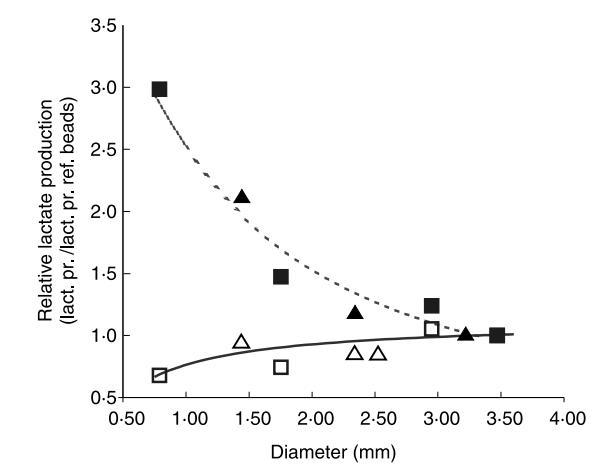
然而,如果乳酸生產速率基于表面積而不是總體積計算,則觀察到較小差異。記錄的基于珠表面積的1.4 mm珠乳酸生產速率僅比參考珠觀察到的速率低14%。如圖2模擬所示,這些觀察與假設一致,即主要位于珠表面附近的細胞貢獻乳酸生產。
pH依賴性固定化乳酸乳球菌亞種lactis的性能
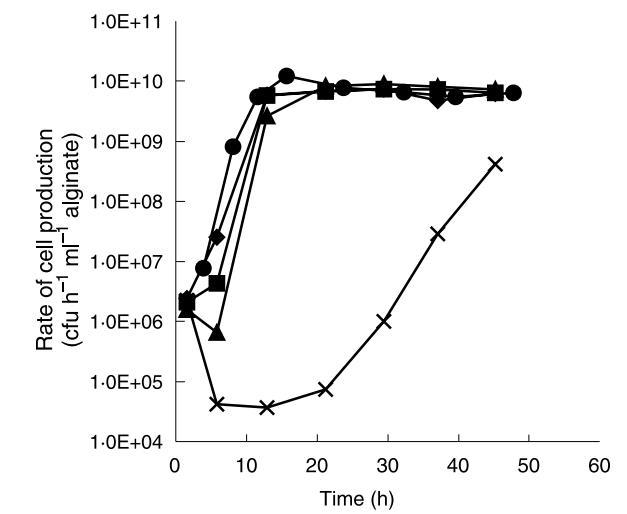
由于乳酸菌的生長伴隨乳酸生產,不同尺寸珠的結果表明大多數乳酸菌生長位于珠最外部。由于珠最外層生物量濃度似乎穩定,該區域的生物量生長可能釋放到周圍介質中。根據先前研究,珠內部生物量被未解離乳酸和低pH抑制。因此,升高周圍介質pH可能用于影響珠內生物量分布和隨后細胞釋放,通過促進珠內部生長和抑制外圍生長。為了研究這個想法,記錄了L.lactis亞種lactis在給定培養基中不同控制pH值下的生長速率。基于這些實驗,在固定化細菌連續發酵實驗中使用以下pH值:6.5、8.50、8.75、9.00和9.25。所有發酵在發酵前2小時在pH 6.5下運行,以在珠中建立保護性pH梯度。細胞釋放速率,監測為自由細胞生產速率,在發酵期間各種間隔測定。每個發酵的自由細胞生產速率如圖3所示。
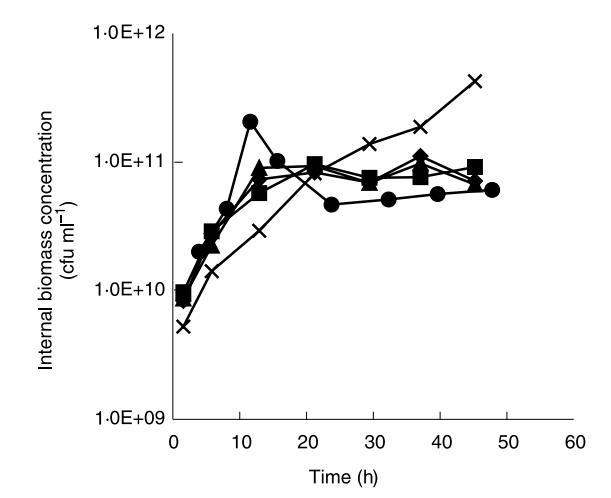
珠內生物量濃度和流出物中乳酸濃度在同一間隔測定。珠內細胞密度在發酵期間的時間過程如圖4所示,而觀察到的乳酸生產速率如圖5所示。
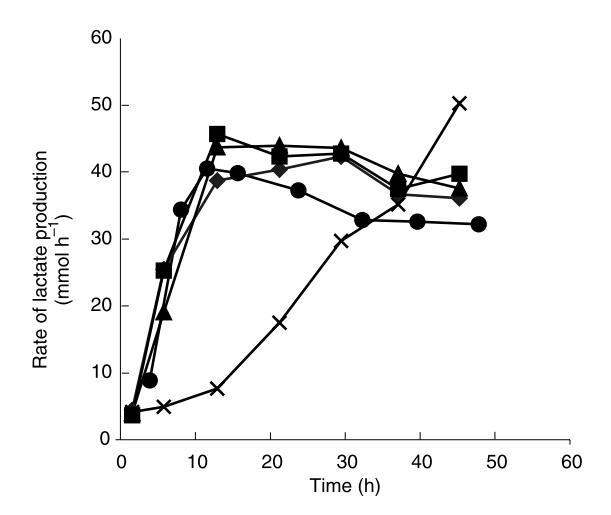
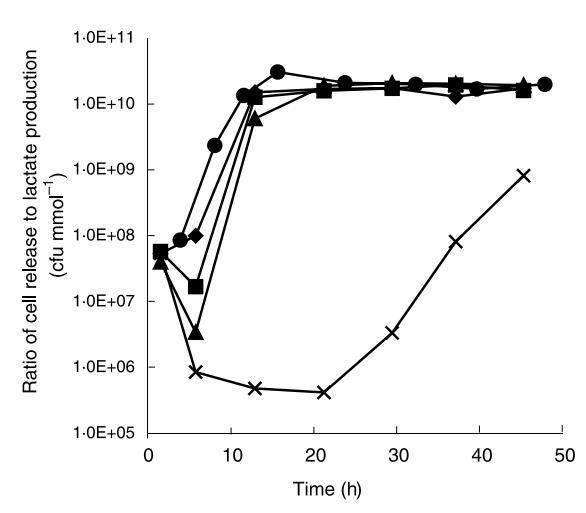
為了確定觀察到的細胞釋放減少是否實際由于減少細胞釋放而非僅代謝活性降低的后果,細胞釋放速率與乳酸生產速率的比值在發酵期間間隔如圖6所示。
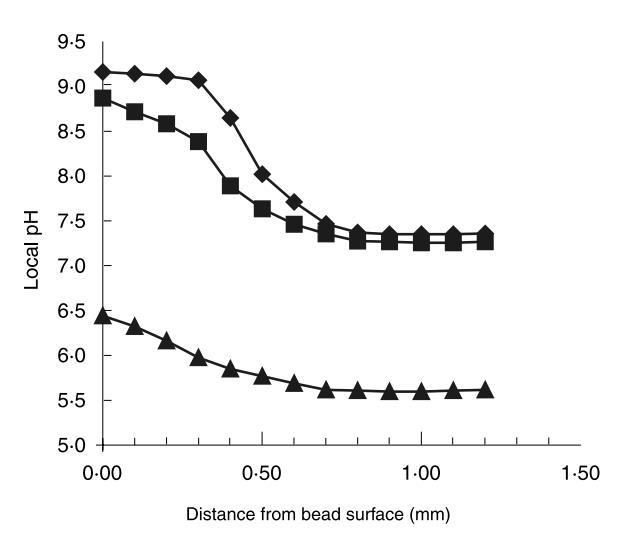
藻酸鹽珠內pH梯度在發酵22小時于pH 6.50、9.00和9.25后如圖7所示。
細胞釋放速率在發酵早期階段增加。在pH 6.50下運行的發酵在連續發酵12-15小時后達到穩態細胞釋放速率。在接下來33小時發酵期間僅觀察到細胞釋放速率的微小變化。這與連續發酵期間內部生物量分布分析結果一致。
隨著pH增加,觀察到細胞釋放速率的變化。然而,所有發酵,除了在pH 9.25下操作的發酵,在24小時內達到與在pH 6.50下運行的發酵相似的穩態細胞釋放速率。在pH 9.25下運行的發酵中,隨著pH改變,觀察到細胞釋放速率的初始急劇下降,導致細胞釋放速率比其他發酵的穩態水平降低10倍。在發酵剩余期間,細胞釋放速率穩定增加,但未看到穩態。發酵48小時后,細胞釋放速率仍比在較低pH下發酵的穩態細胞釋放速率低約10倍。
周圍介質的改變條件也影響了發酵期間珠中生物量濃度的過程。在pH 6.5、8.5、8.75和9.00下發酵的珠中生物量濃度在連續發酵24小時內達到穩態值。然而,在pH 9.25下發酵的珠中生物量從未在48小時發酵內達到穩態濃度。盡管周圍介質pH增加減緩了內部生物量濃度的初始增加,這些珠達到了生物量濃度約五倍于在pH 6.5、8.5、8.75和9.0下發酵的其他珠觀察到的穩態生物量濃度。周圍介質的改變pH似乎也影響了乳酸生產速率。在pH 9.25下運行的發酵中乳酸生產速率在發酵早期階段不像其他發酵那樣增加,但與其他發酵相反,它在整個48小時發酵期間持續增加。在發酵結束時,在pH 9.25下運行的發酵中觀察到乳酸生產速率增加25%,相比其他發酵,盡管細胞釋放速率仍相對低一個數量級。
這些大變化背后的機制假定與珠內pH梯度差異相關。從圖7可見,在pH 9.00和9.25下發酵22小時的珠最外部pH梯度有顯著差異。在珠內部,局部pH似乎差異較小。盡管在高pH下發酵的珠中pH梯度更陡,但在高pH下發酵的珠中心局部pH僅比在pH 6.5下發酵的珠高1.7單位。
因此,從圖6和圖7可見,可以改變介質外部pH,使得生長在周圍介質和珠外圍不利,而生長和乳酸生產在珠內部繼續。這種情況改變了細胞釋放速率與乳酸生產速率的比值,導致產物流包含更少自由細胞。這些實驗也說明,從圖7和圖8可見,固定化由于擴散限制和伴隨的珠內pH梯度導致pH操作范圍的大偏移。
這些數據表明固定化細胞可以成功應用于基于在pH耐受性極端上限操作的應用。
 相關新聞
相關新聞